实验中的下列操作叙述正确的是( )
| A.用浓硫酸配制稀硫酸时,可将量取好的浓硫酸直接转移至容量瓶后再加水定容。 |
| B.蒸馏操作时,需要将温度计水银球插入到蒸馏液体的液面以下 |
| C.用蒸发方法使NaCl从溶液中析出时,应加热至蒸发皿中溶液全部蒸干 |
| D.蒸馏时沸石的作用是防止液体受热时突然沸腾 |
某有机物链状分子中含a个 —CH3 , b个—CH2— , m个 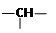 , n个C原子,其余为羟基。则该有机物分子中羟基的个数为()
, n个C原子,其余为羟基。则该有机物分子中羟基的个数为()
| A.2n+3m-a+2 | B.n+m+a-b | C.2m+n+2-a | D.m+2n+2-a |
某烃结构式如下: -C≡C-CH=CH-CH3,有关其结构说法正确的是()
-C≡C-CH=CH-CH3,有关其结构说法正确的是()
| A.所有原子可能在同一平面上 | B.所有原子可能在同一条直线上 |
| C.所有碳原子可能在同一平面上 | D.所有碳原子可能在同一直线上 |
实验室里不宜长期放置,应在使用时才配制的试剂是( )
①酚酞试液 ②银氨溶液 ③Na2CO3溶液 ④Cu(OH)2悬浊液
⑤酸性FeCl3溶液 ⑥FeSO4溶液 ⑦NaCl溶液 ⑧氯水
| A.②⑤⑥⑧ | B.①③④⑤ | C.①②⑤⑦ | D.②④⑥⑧ |
某天然有机化合物,其结构如右下图所示,关于该化合物的说法正确的是()
| A.该化合物可以发生消去、银镜、显色等多种反应 |
| B.该化合物的分子式是C17H16O5 |
| C.该化合物中全部的碳、氧原子可能在同一个平面 |
| D.一定条件下1mol该化合物最多可以和8molH2发生加成反应 |
已知酸性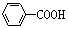 >H2CO3>
>H2CO3> >HCO3—,现要将
>HCO3—,现要将 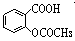 转变为
转变为 ,可行的方法是( )
,可行的方法是( )
| A.与足量NaOH溶液共热,再通入足量HCl |
| B.与稀硫酸共热后,加入足量的 NaOH |
| C.加热该物质溶液,再通入足量的CO2 |
| D.与足量NaOH溶液共热,再通入足量CO2 |