在给定的溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
| A.所含溶质有Na2SO4的溶液:K+、AlO2-、NO3-、Al3+ |
| B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
常温下,某溶液中由水电离的c(H+)=1×10-13 mol·L-1,该溶液可能是()
①二氧化硫水溶液②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液
| A.①④ | B.①② | C.②③ | D.③④ |
在t℃下,某反应达到平衡,平衡常数K=c(NO)c(SO3)/c(NO2)c(SO2)。恒容时,温度升高,NO浓度减小。下列说法正确的是()
| A.该反应的焓变为正值 | B.恒温下增大压强,反应体系的颜色加深 |
| C.升高温度,逆反应速率减小 | D.该反应化学方程式为NO+SO3 NO2+SO2 NO2+SO2 |
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内部都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是()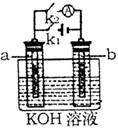
| A.断开K2,闭合K1一段时间,溶液的PH要变大 |
| B.断开K1,闭合K2时,b极上电极反应式为:2H++2e―=H2↑ |
| C.断开K2,闭合K1时,a极上的电极反应式为:4OH―—4e―=O2↑+2H2O |
| D.断开K1,闭合K2时,OH―向b极移动 |
根据下列事实,判断离子的氧化性顺序为()
①A+B2+=A2++B②D+2H2O=D(OH)2+H2↑
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-→E,B→B2+ +2e-
A.D2+>A2+>B2+>E2+B.D2+>E2+>A2+>B2+C.E2+>B2+>A2+>D2+D.A2+>B2+>D2+>E2+
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为()
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |