已知在25℃,101kPa下,lgC8H18(辛烷,相对分子质量为114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
| A.C8H18(1)+ 25/2O2(g)=8CO2(g)+9H2O(1) △H=-5517.6kJ·mol-1 |
| B.C8H18(1)+ 25/2O2(g)=8CO2(g)+9H2O(1) △H=+5517.6kJ·mol-1 |
| C.C8H18(1)+ 25/2O2(g)=8CO2(g)+9H2O(g) △H=-48.40kJ·mol-1 |
| D.C8H18(1)+ 25/2O2(g)=8CO2(g)+9H2O(1) △H=-48.40kJ·mol-1 |
如图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是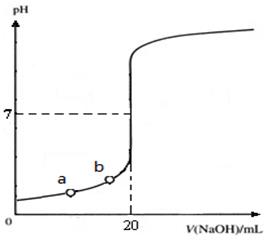
| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为0.0100 mol·L-1 |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应,溶液刚好显中性 |
| D.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg3 |
下列各组数据关系中,前者比后者大的是
| A.100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+数目 |
| B.常温下pH=4的KHSO4溶液和CH3COOH溶液中由水电离出的OH—离子浓度 |
| C.纯水在100℃时的pH和25℃时的pH |
| D.100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+浓度 |
某原电池装置如右图,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
| A.正极反应为AgCl +e-=Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
| A.在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多 |
| B.同价态的阳离子,甲比乙的氧化性强 |
| C.甲能跟稀盐酸反应放出氢气而乙不能 |
| D.将甲、乙作电极组成原电池时,甲是正极 |
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。下列说法正确的是
A.稀释前,c(A)=10 c(B)
B.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
C.稀释前,A溶液中由水电离出的OH-的浓度大于10-7 mol/L
D.由图可知,A为强碱、B为弱碱