常温下pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为 ( )
| A.1:9 | B.1:11 | C.9:1 | D.11:1 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 |
2 min后,试管里出现凝胶 |
稳定性:盐酸>硅酸 |
| B |
向某溶液中先滴加KSCN溶液,再滴加少量氯水 |
先无明显现象,后溶液变成血红色 |
溶液中含有Fe3+,没有Fe2+ |
| C |
常温下,向浓硫酸中投入铁片 |
铁片不溶解 |
常温下,铁不与浓硫酸反应 |
| D |
向盛有碘水的试管中加入CCl4后充分振荡静置 |
液体分层,上层基本无色,下层紫色 |
碘在CCl4中的溶解度较大 |
设NA为阿伏加德罗常数,则下列说法正确的是
| A.一定条件下,2.3g Na完全与O2反应生成3.6g产物时得到的电子数为0.1NA |
| B.1L 0.1mol醋酸溶液中所含分子数少于0.1NA |
| C.水分子中1mol羟基含有的电子总数为9NA |
| D.1 mol H2O2含有极性共价键键数为NA,含有非极性共价键为键数2NA |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是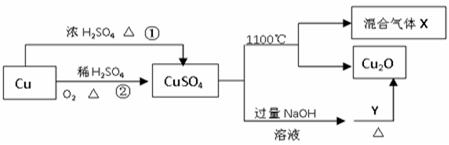
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D.将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |
关于下列各装置图的叙述中,正确的是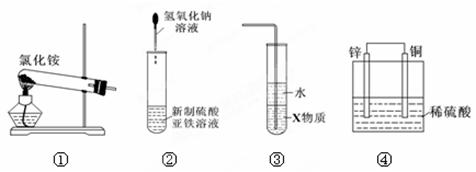
| A.实验室用装置①制取氨气 |
| B.装置②可用于制备氢氧化亚铁并观察其颜色 |
| C.装置③中X为苯,可用于吸收氨气,并防止倒吸 |
| D.装置④是原电池,锌电极为负极,发生氧化反应 |
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法正确的是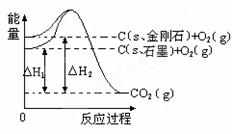
| A.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.C(s、石墨)==C(s、金刚石)△H= +1.9 kJ•mol-1 |