氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
(1)HCN分子中含有4个共价键,写出HCN的结构式:____________。
(2)KCN溶液显碱性,原因是____________(用离子方程式表示)。
(3)下列有关方程式不正确的是____________。 A.(CN)2+2NaOH===NaCN+NaCNO+H2O
A.(CN)2+2NaOH===NaCN+NaCNO+H2O
B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O
C.I2+2KCN===2KI+(CN)2
D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2
(4)处理CN-的工业废水常用ClO-氧化处理生成CNO-,反应的离子方程式如下:
aCN-+bClO-+2cOH-===dCNO-+eN2+fCO+bCl-+cH2O
上述化学方程式可能的配平化学计量数有多组,回答下列问题。
①方程式中e∶f的值为____________;
A.1 B.1/2 C.2 D.不能确定
②若d=e=1,则b=____________。
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图: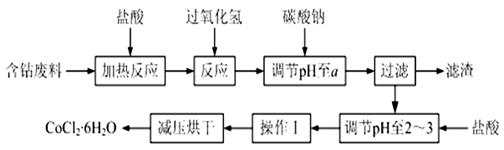
已知:①钴与盐酸反应的化学方程式为 :Co+2HCl=CoCl2+H2↑
:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH 见下表:
见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
⑴加入过氧化氢的作用是(用离子方程式表示)。
⑵加入碳酸钠调节pH至a得到的滤渣可部分溶于氢氧化钠溶液, a的范围是。
⑶操作Ⅰ包含3个基本实验操作,它们是。
⑷制得的CoCl2·6H2O需减压烘干的原因是。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合 成甲醇:
成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)ΔH2
CH3OH(g) + H2O(g)ΔH2
①反应Ⅱ的平衡常数表达式是 。
。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH2= -566.0 kJ/mol
③  H2O(g) = H2O(l)ΔH3= -44.0 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
H2O(g) = H2O(l)ΔH3= -44.0 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
(3) 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。该电池正极的电极反应为。
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。该电池正极的电极反应为。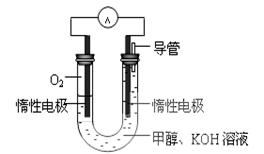
下面是以化合物I为原料合成一种香精(化合物Ⅵ)的合成路线,反应在一定条件下进行。化合物Ⅵ广泛用于香精的调香剂。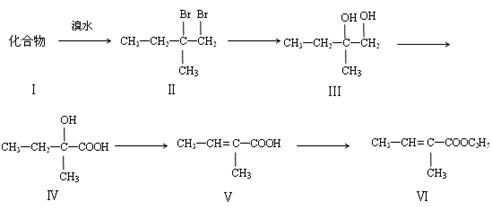
回答下列问题:
(1)化合物Ⅰ生成化合物Ⅱ的反应原子利用率可达100%,化合物Ⅰ的结构简式为。
(2)化合物Ⅲ生成化合物Ⅳ发生反应。
(3)化合物Ⅴ的多种同分异构体中,与化合物Ⅴ官能团种类相同且无支链的共有_____种。
(4)化合物Ⅵ不能发生的反应类型是(填字母)。
| A.加成反应 | B.酯化反应 | C.水解反应 | D.加聚反应 |
(5)写出化合物Ⅵ在一定条件下反应,生成高分子化合物的化学方程式:。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为_________________________。
⑵ 检验TiO2·x H2O中Cl-是否被除净的方法是_________________________。
⑶ 下列可用于测定TiO2粒子大小的方法是____________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
⑷ 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是______________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_______(填字母代号)。
⑸ 滴定终点的现象是__________________________________________。
⑹ 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c m ol·-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_______________
ol·-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_______________ ____。
____。
⑺ 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果____。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是。
(3)把KI换 成KBr,则CCl4层变为______色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
成KBr,则CCl4层变为______色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
(4)加碘盐中含碘量为25.4mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若将Kl与Cl2反应制KIO3,至少需要消耗Cl2L(标准状况,保留2位小数)