下列实验能达到目的或操作正确的是 ( )
| A.称量NaOH固体时,应先在盘上各放一张干净滤纸,再进行称量 |
| B.配制一定浓度溶液的过程中,容量瓶里有少量晶体未溶解,可在酒精灯上小心加热 |
| C.配制450mL0.5mol/L稀硫酸溶液时,用量筒取22.5mL10mol/L的浓硫酸进行稀释 |
| D.质量分数为w%的氨水与水等体积混合,所得溶液的质量分数小于0.5w% |
下列说法正确的是
A.在加热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质都会发生变性
B.氨基酸、蛋白质、油脂都含有C、H、O、N四种元素
C.生活中食用的食醋、植物油、动物蛋白等物质都是混合物
D.乙烯、聚乙烯、甲苯均能使酸性高锰酸钾溶液褪色
全钒流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示,其中H+的作用是参与正极反应,并通过交换膜定向移动使右槽溶液保持电中性。下列有关说法不正确的是()
| A.放电时当左槽溶液逐渐由黄变蓝,其电极反应式为:VO2+ +e一+2H+=VO2+ +H2O |
| B.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为l.0mol |
| C.充电时,H+由左槽定向移动到右槽 |
| D.充电过程中,右槽溶液颜色逐渐由绿色变为紫色 |
根据表中信息判断,下列选项正确的是()
| A.第①组反应的其余产物为H2O |
| B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 |
| C.第③组反应中生成1mol Cl2,转移电子5mol |
| D.氧化性由强到弱顺序为MnO4 >Cl2> Fe3+> Br2 |
乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如下:
下列叙述正确的是()
| A.该反应不属于取代反应 |
| B.乙酸香兰酯的分子式为C10H8O4 |
| C.FeCl3溶液可用于区别香兰素与乙酸香兰酯 |
| D.乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
下列判断不正确的是()
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后溶液中:c(OH-)=c(K+)-c(A-)=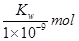 ·L-1
·L-1
C.实验②反应后的溶液中:c(A-)+c(HA) 0.1mol·L-l
0.1mol·L-l
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)