某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
|


①检查装置气密性
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
③装好实验装置。
④加热,开始反应,直到产生一定量的气体
⑤停止加热,测量收集到气体的体积
⑥准确称量试管和残留物的质量为b g。
⑦测量实验室的温度。
⑧处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性? 。
(2)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三 步操作的正确顺序是: (请填写步骤代号)。
步操作的正确顺序是: (请填写步骤代号)。
(3)如果实验中得到的氧气体积是cL(25℃、1.0l×l05Pa,该条件下气体的摩尔体积为Vm).氧气的摩尔质量的计 算式为(含a、b、c,不必化简):M(O2)= 。
算式为(含a、b、c,不必化简):M(O2)= 。
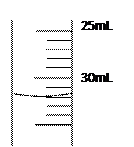 (4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(5)若计算所得结果比实际值偏大,则可能的原因是___________
| A.氯酸钾中混有不产生氧气的固体杂质 |
| B.第一次称量时药品、砝码反置 |
| C.药品未完全分解 |
| D.量筒内液体被排尽 |
E.装置漏气
F.读数时俯视量筒刻度
实验室用纯碱(Na2CO3·10H2O)配制480mL 0.1mol/L Na2CO3溶液,实际操作步骤有:
(1)需称量纯碱的质量为___________g
(2)配制溶液时下列仪器中:
| A.锥形瓶 | B.托盘天平 | C.烧杯 | D.胶头滴管E.药匙 |
不需要用到的是_____(填序号),尚缺的玻璃仪器有_____和_____(写名称)。
(3)人们常将配制过程简述为以下各步骤:
A冷却 B称量 C洗涤 D定容
E溶解 F摇匀 G转移 H装瓶。
其正确的操作顺序应是_______ (填序号)。
①B E A G C G D F H②B E G A C G F D H
③B E F G C G D H A④B E A G C G D H F
(4)在此配制过程中,下列情况会使配制结果偏高的是______________ (填序号)
①纯碱晶体部分失水②容量瓶使用时未干燥
③移液时未洗涤烧杯和玻璃棒④定容时俯视刻度线观察液面
⑤定容时仰视刻度线观察液面
⑥摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线
某同学用锌铜合金粉末与等体积、等浓度的稀硫酸分别做多次实验,现列出其中四组数据,请仔细阅读,回答有关问题:
| 实验编号 |
锌铜合金质量/g |
硫酸/mL |
硫酸锌/g |
| 1 |
2.0 |
56 |
4.83 |
| 2 |
3.0 |
56 |
|
| 3 |
4.0 |
56 |
9.66 |
| 4 |
5.0 |
56 |
9.66 |
(1)上表中空缺的数据应为_______________;
(2)从上面的数据可以判断实验____________(编号)是恰好完全反应。
(3)实验1中可选用_____________(物质名称)作为已知条件,计算放出氢气的体积是___________mL(标准状况)。
(4)锌铜合金中锌的质量分数为_____________。
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式________________________;
(2)下列四种情况下,离子方程式与(1)相同的是_____________(填序号)
| A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量 |
| B.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀 |
| C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性 |
| D.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至过量 |
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用如图中的曲线表示是_______(填序号)
(4)向Ba(OH)2溶液中加入密度为1.165g/cm3的硫酸溶液,直到恰好完全反应为止,已知所生成的沉淀的质量等于加入的H2SO4溶液的质量,则硫酸溶液的浓度为_______mol/L。
pH=12的NaOH溶液100mL,要使它的pH=11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加____________mL;
(2)如果加入pH=10的NaOH溶液,应加____________mL;
(3)如果加0.01 mol/L HCl,应加____________mL。
(1)将等质量的Zn粉分别投入:a:10mL0.1 mol•L-1HCl和b:10mL0.1 mol•L-1的醋酸中。
①若Zn不足量,则反应速率a___________b;(填“>”、“=”或“<”)
②若Zn过量,产生H2的量a__________b;(填“>”、“=”或“<”)
(2)将等质量的Zn粉分别投入pH=1体积均为10mL的a:盐酸 b:醋酸中。
①若Zn不足量,则反应速率a__________b;(填“>”、“=”或“<”)
②若Zn过量,产生H2的量a__________b;(填“>”、“=”或“<”)