某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,反应t min后测得c(X2) =0.4mol•L-1,c(Y2)=0.8mol•L-1,生成的c(Z)=0.4mol•L-1,则该反应的化学方程式可表示为( )。 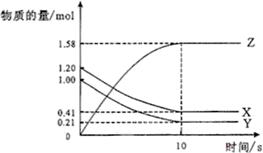
A.X2+2Y2 2XY2 2XY2 |
B.2X2+Y2 2X2Y 2X2Y |
C.3X2+Y2 2X3Y 2X3Y |
D.X2+3Y2 2XY3 2XY3 |
下列关于化学反应与能量的说法正确的是
| A.铝热反应属于吸热反应 |
| B.对于某一反应,若反应物的总能量大于生成物的总能量,则该反应为吸热反应 |
| C.化学反应中既有物质变化又有能量变化 |
| D.凡经加热而发生的化学反应都是吸热反应 |
下列物质中既含有离子键又含有共价键的是
| A.MgCl2 | B.NaOH | C.H2SO4 | D.H2O |
下列化学用语书写正确的是
A.氯原子的结构示意图: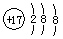 |
B.CH4分子的球棍模型: |
C.氯化镁的电子式: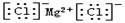 |
D.N2的结构式: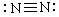 |
2011年5月1日起酒驾入刑。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此原理有关的是
①乙醇易挥发②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物
| A.①③ | B.②③ | C.②④ | D.①④ |
可以用分液漏斗进行分离的混合物是
| A.酒精和碘水 | B.苯和水 | C.乙酸和乙酸乙酯 | D.乙酸和水 |