25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、
890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+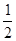 O2(g)="CO(g)" △H= ―393.5 kJ/mol O2(g)="CO(g)" △H= ―393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)△H=" +571.6" kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= ―890.3 kJ/mol |
| D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l)△H= ―2800 kJ/mol |
下列说法正确的是( )
| A.酸溶于水后能促进水的电离,碱溶于水后能抑制水的电离。 |
| B.强酸溶于水后能抑制水的电离,弱酸溶于水后能促进水的电离。 |
| C.任何条件下,只要c(H+)>c(OH-),溶液就一定显酸性。 |
| D.任何条件下,只要pH>7,溶液就一定显碱性。 |
室温下,在pH=12的某碱溶液中,由水电离出来的c(OH-)为()mol·L-1
| A.1.0×10-7 | B.1.0×10-6 | C.1.0×10-2 | D.1.0×10-12 |
对于常温下pH为2的盐酸,叙述正确的是
| A.c(H+)=c(Cl-)+c(OH-) |
| B.与等体积pH=12的氨水混合后所得溶液显酸性 |
| C.由H2O电离出的c(H+)=1.0×10-12mol·L-1 |
| D.与等体积0.01 mol·L-1醋酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-) |
有四种物质的量浓度都是1 mol/L,由1价阳离子和1价阴离子组成的盐溶液,它们分别是AX、BX、AY、BY,据测定AX和BY溶液的pH都等于7而AY溶液的pH大于7,BX溶液的pH小于7,则最可能不水解的盐是( )
| A.BX | B.AY | C.AX | D.AX和BY |
下列与含氯化合物有关的说法正确的是
A.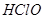 是弱酸,所以 是弱酸,所以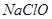 是弱电解质 是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体,是与水解有关 |
C.醋酸溶液和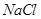 溶液均通过离子导电,是因为其溶质均为强电解质 溶液均通过离子导电,是因为其溶质均为强电解质 |
| D.22.4L氯气通入水中,理论上需要转移NA个电子(NA阿伏伽德罗常数) |