为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈黄绿色,说明氯水中肯定含有的粒子是 ;
(2)取少量氯水于试管中,滴入硝酸酸化的AgNO3溶液,有白色沉淀生成,说明氯水中含有的粒子是 ;
(3)在氯水的试管中加有色布条褪色,说明氯水中含有 ;
(10分)
(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA和1mol NaHCO3能完全反应,则A的结构简式是,写出与A具有相同官能团的A的所有同分异构体的结构简式
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是
(3)A与B在浓H2SO4作用下发生酯化反应后生成有机物D的结构简式
(6分)菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸(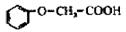 )发生化
)发生化
|
反应的产物。据此回答下列问题:
(1)甲一定含有的官能团的名称是 。(9分)写出下列变化的化学方程式,并注明反应条件和反应类型。
(1)乙烯和HCl反应的化学方程式,反应类型为
(2)苯和浓HNO3反应的化学方程式,反应类型为
(3)苯和溴反应的化学方程式,反应类型为
(8分)化学式为C2H6O的化合物A具有如下性质:
A+Na反应慢慢产生气泡;A+ CH3COOH反应产生具有果香味的产物
(1)根据上述信息,对该化合物可作出的判断是_____
| A.一定含有—OH | B.一定含有—COOH | C.A为乙醇 | D.A为乙醛 |
(2)含A的体积分数为75%的水溶液可以用作
(3)写出A催化氧化的化学方程式
(4)化合物A和CH3COOH反应生成的有香味的产物的结构简式为
(6分)苹果酸( )常用于汽水、糖果的添加剂,写出苹果酸分别与下列物质反应的化学方程式:
)常用于汽水、糖果的添加剂,写出苹果酸分别与下列物质反应的化学方程式:
(1)Na(2)Na2CO3
(3)CH3CH2OH(浓H2SO4,△)