在盛有足量 A 的体积可变的密闭容器中,加入B ,发生反应: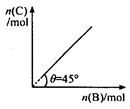
A (s)+2B(g) 4C(g) + D ( g );△H < 0 。
4C(g) + D ( g );△H < 0 。
在t℃.p KPa下达到平衡。平衡时 C 的物质的量与加入的 B
的物质的量的变化关系如右图。下列说法正确的是 ( )
A.平衡 时B的转化率为33.3 % 时B的转化率为33.3 % |
| B.若再加入B,则再次达到平衡时正.逆反应速率均增大,但仍然相等 |
| C.若再加人4molC和1molD ,则再次达到平衡时体系气体密度减小,平均摩尔质量不变 |
| D.若温度变为(t+10)℃,则θ<45° |
常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是( )
| A.若c(OH-)>c(H+),则a=b | B.若c(K+)>c(CH3COO-),则a>b |
| C.若c(OH-)=c(H+),则a>b | D.若c(K+)<c(CH3COO-),则a<b |
常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入的水和氢氧化钠溶液的体积比为( )
| A.5:1 | B.6:1 | C.10:1 | D.11:1 |
在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可得到该物质固体的是()
| A.Al2(SO4)3 | B.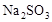 |
C.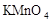 |
D.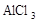 |
T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是()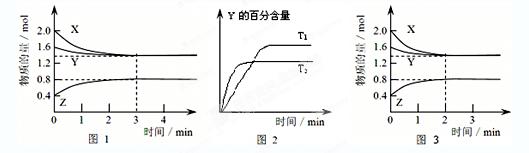
| A.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min) |
B.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
现有强酸甲溶液的pH=1,强酸乙溶液的pH=2,则酸甲与酸乙的物质的量浓度之比不可能的是( )
| A.2∶1 | B.5∶1 | C.10∶1 | D.20∶1 |