称量物质的质量一般用托盘天平,称量时砝码应放在_______盘上。用量筒量液体读数时,视线要与量筒内液体的_______保持水平,如果采用仰视的话,将会使读数_______。(填“偏大”或“偏小”)
【原创】现有A、B、C、D、E五种金属片,①把A、C用导线连接后同时浸入稀硫酸铜溶液中,A上有红色固体产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生氧化反应;③把A、B用导线连接后同时浸入稀硫酸溶液中,电流方向为B→导线→A;④将E放入水中,立即有气体产生。根据上述情况,回答下列问题:
(1)在①中,金属片_______发生氧化反应;
(2)在②中,金属片_______作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片_______上有气泡产生;
(4)上述五种金属的活动性顺序是__________________。
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式_________________________________________。
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;
负极反应:________________________;
电解质溶液pH的变化_______.(填“增大”“减小”或“不变”.下同)
(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。
请按要求回答下列问题:
(1)若B、D为短周期同一主族的非金属单质,则反应(III)中氧化产物与还原产物的物质的量之比为___。
(2)若A、B、C均为短周期元素组成的化合物,且溶液都显碱性,D为植物光合作用必须吸收的气体,物质A中化学键的类型为______________________,相同温度下的溶解度B____________C(填“大于、小于、等于”)。
(3)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则检验B溶液中阳离子的试剂为_________;C的溶液保存时,常加入D的目的是__________________。
(4)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,写出反应(III)的离子方程式是_______________________________;符合条件的D物质可能是_______________(填序号)。
①硫酸 ②碳酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
【改编】Ⅰ.M、A、B、C、D、E均为短周期主族元素,A的最外层电子数是M的4倍,A、B、C、D、E、F在周期表中位置如图所示。(请用化学用语作答)
| A |
B |
C |
D |
| E |
F |
(1)A在周期表中的位置 。
(2)D、E、F三种元素形成的简单离子半径由大到小的顺序为 。
(3)由M、B、C三种元素以原子个数比4:2:3形成化合物Q,Q中所含化学键类型有 。检验该化合物中阳离子的方法是 。(用离子方程式表示)。
(4)B与C可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
Ⅱ.一定条件下,2X(g)+Y(g) 2Z(g)+W(s)。
2Z(g)+W(s)。
(5)若反应在一定温度的恒容条件下进行,按下表数据投料,反应达到平衡状态,数据如下:
| 物质 |
X |
Y |
Z |
W |
| 起始投料/ mol |
2 |
1 |
2 |
0 |
| 平衡时物质的量 |
0.2 |
则平衡时容器的压强与原来压强的比值为________,X的转化率为__________。
(8分)用下面的原子或离子结构示意图的编号(A、B、C、D)填空: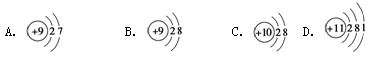
(1)核外电子层排布相同的是__________和___________;
(2)属于同种元素的是__________和__________;
(3)属于金属元素的是____________________;
(4)写出D参加化学反应后所得离子的结构示意图___ ____。