某烃分子式为C5H10,按以下要求写出烃的结构简式,
(1)能使酸性KMnO4 溶液褪色,且该烃有顺反异构,该烃的结构简式为 。
(2)能使酸性KMnO4 溶液褪色,在Ni催化作用下与H2加成得到带一个支链的烷烃,且该烷烃可由炔与等物质的量H2加成而得。该烃的结构简式为 ;
(3)能使酸性KMnO4 溶液褪色,在Ni催化作用下与H2加成得到带一个支链的烷烃,该烃与水加成后,可得两种醇,其中一种醇在Cu作催化剂催化氧化后所得产物可发生银镜反应。另一醇不被催化氧化,该烃结构简式是 。
据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
① (苯胺,弱碱性、易氧化)
(苯胺,弱碱性、易氧化)
②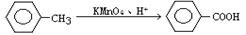
下面是PAS—Na的一种合成路线(部分反应的条件未注明):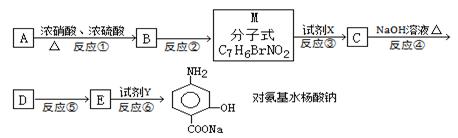
(1)A与浓硝酸和浓硫酸的混合物可以发生取代反应,在30℃时反应主要得到B和它的一种同分异构体,在一定条件下也可以反应生成TNT,请写出A制取TNT的化学方程式:__________________,TNT的系统命名法为__________________。
(2)写出反应②的化学方程式,注明反应条件并配平:__________________。
(3)本题中的中间产物M的官能团的名称为____________,与题中M具有相同官能团的同分异构体并属于芳香族化合物的共有____________种(不含M本身)(不考虑立体异构)。
(4)反应①的反应类型为__________________。
(5)试剂X为,试剂Y为__________________。
甘蔗渣可综合利用,回答下列问题。
Ⅰ.甘蔗渣可生成一种常见单糖A,A在乳酸菌的作用下生成有机物B,B经过缩聚反应生成可降解塑料,其结构简式为: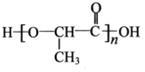
(1)A的分子式是____________;
(2)下列有关B的叙述正确的是____________(填序号);
A. B的分子式为C3H6O3
B. 1 mol B可与2 mol NaOH反应
C. 1 molB与足量的Na反应可生成1 molH2
(3)B在一定条件下可生成C,C能使溴的四氯化碳溶液褪色。B生成C的化学方程式是____________;
Ⅱ. 甘蔗渣还可生产一种重要的化工原料D,D的相对分子质量为90,1 mol D与足量NaHCO3反应放出标准状况下44.8 L CO2。
(4)D的官能团名称是____________;
(5)等物质的量的D与乙二醇在催化剂作用下可生成链状高分子化合物,其化学方程式是________________
苯甲酸和苯甲酸钠均是食品防腐剂。某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应。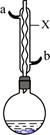
按如下流程分离出苯甲酸:
已知:① 苯甲酸熔点为122 ℃,沸点为249 ℃。
② 不同温度下苯甲酸在水中溶解度:4 ℃—0.18 g,18 ℃—0.27 g,75 ℃—2.2 g;
③
请回答下列问题:
(1)仪器X的名称是____________,冷却水应从口进入____________(填“a”或“b”)。
(2)分离苯甲酸的操作中,冰水浴冷却滤液的主要目的是____________,制得的苯甲酸晶体中可能含有的杂质是____________,为进一步提纯,应采用的方法是____________。
(3)芳香化合物A与苯甲酸分子式相同,A与NaOH溶液反应生成两种盐,该反应的化学方程式是____________。
如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。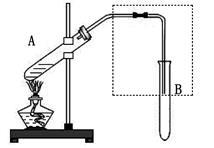
请根据该装置回答下列问题:
(1)若用乙醇与乙酸反应制取乙酸乙酯,反应的化学方程式为__________________,试管B中应加入____________。虚线框中的导管除用于导气外,还兼有__________________作用。
(2)若用该装置分离乙酸和1-丙醇,则在试管A中除加入1-丙醇与乙酸外,还应先加入适量的试剂____________,加热到一定温度,试管B中收集到的是____________(填写结构简式)。冷却后,再向试管A中加入试剂____________,加热到一定温度,试管B中收集到的是____________(填写结构简式)。
(1)写出下列各物质的名称,填入括号内。
CH4 → CH3Cl → CH3OH → HCHO → HCOOH → HCOOC2H5
(甲烷)→()→(甲醇)→()→()→()
(2)某有机物的结构简式如图: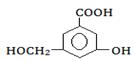
①当其和______________反应时,可转化为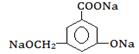 。
。
②当其和______________反应时,可转化为 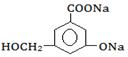 。
。
③当和_______________反应时,可转化为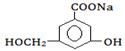 。
。
④欲将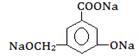 转化为
转化为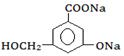 ,则应加入________________。
,则应加入________________。