在密闭容器中进行下列反应:M(g)+N(g)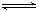 C(g)+2L此反应符合下面图象,下列叙述正确的是
C(g)+2L此反应符合下面图象,下列叙述正确的是
A .正反应吸热,L是气体
.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4 m
2C(g)达到平衡时,A、B和C的物质的量分别为4 m ol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
ol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
可逆反应:3 A(g)  3 B(?)+C(?) △H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
3 B(?)+C(?) △H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
| A.B和C可能都是固体 | B.若C为固体,则B一定是气体 |
| C.B和C一定都是气体 | D.B和C可能都是气体 |
在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会加深;改变压强时,反应速率将发生变化,而平衡状态不发生改变的是
A.2NO + O2 2NO2(放热) 2NO2(放热) |
B.N2O4 2NO2(吸热) 2NO2(吸热) |
C.Br2(g)+ H2 2HBr(放热) 2HBr(放热) |
D.2NO N2 + O2(吸热) N2 + O2(吸热) |
在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-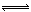 [CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
[CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
| A.蒸发浓缩 | B.加水稀释 | C.加入AgNO3 | D.加入食盐晶体 |