(10分)在四个脱落标签的试剂瓶中,分别盛有盐酸、BaCl2溶液、Na2CO3溶液、AgNO3溶液,为了鉴别各瓶试剂将它们分别编号为A、B、C、D两两混合,其实验现象为:
A+B→无色气体 B+C→白色沉淀 A+D→白色沉淀 A+C→无明显现象
(1)由此推断各试剂瓶中所盛试剂为(填化学式)
A: B: C: D:
(2)写出下列反应的离子方程式
①A+B: ②B+C:  ③A+D:
③A+D:
用于分离或提纯物质的方法有:
| A.蒸馏(分馏) | B.萃取 | C.过滤 | D.重结晶 E.分液。 |
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号.)
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒()
(2)分离四氯化碳与水的混合物()
(3)分离汽油和煤油()
(4)分离碘水中的碘单质()
(5)提纯氯化钠和硝酸钾混合物中的硝酸钾 ()
求25℃时以下溶液的pH
(1)pH=3的盐酸与pH=5的硫酸等体积混合后,pH= ____________
(2)pH=10和pH=12的两种NaOH溶液等体积混合后,pH= ____________
(3)pH=9的NaOH溶液稀释到原来的10倍后,pH= ____________,再稀释到原来的1000倍后,pH___________。
(4)pH=12的NaOH和pH= 4的HCl等体积混合后,pH= ____________
(5)pH=10的NaOH和pH=1的HCl等体积混合后,pH= ____________
(6)pH=12的NaOH和pH=2的HCl等体积混合后,pH= ____________
泡沫灭火器的工作原理就是我们学习的盐类水解,它是彻底的双水解,
(1)灭火器有两个桶构成,一个是外面的钢桶,用来盛装(硫酸铝、碳酸氢钠填药品的化学式)一个是里面看不到的塑料桶,用来盛装。(同上)
(2)用离子方程式表示塑料桶盛放该试剂的原因。
(3)用离子方程式表示其工作原理。
(4)用碳酸氢钠而不用碳酸钠做灭火器的药品其原因是。
(5)碳酸氢钠溶液中质子守恒的表达式是。
在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________(2)A的转化率为_________________
(3)生成D的反应速率为_________________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各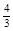 mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
(1)已知:2H2(g) + O2(g) ==2H2O(g);△H= –483.6 kJ·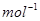 , H2(g) + 1/2O2(g) ==H2O(l)的△H=–285.8 kJ·
, H2(g) + 1/2O2(g) ==H2O(l)的△H=–285.8 kJ·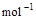 ,由此可知,在等温下蒸发18g液态水需吸收_____kJ的热量。
,由此可知,在等温下蒸发18g液态水需吸收_____kJ的热量。
(2)工业制氢气的一个重要反应是:CO(g)+ H2O(g) ="=" CO2(g) + H2(g)
已知25℃时:
C(石墨) +O2 (g) ="=" CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) ="=" CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)="=" H2O(g) △H3=-242kJ·mol-1,试计算25℃时CO(g)+ H2O(g) ="=" CO2(g) + H2(g)的反应热_______ kJ·mol-1
(3)在25℃、101KPa时,____________________________时所放出的热量,叫做该反应的燃烧热。在25℃、101KPa时,1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,则能表示乙醇燃烧热的热化学方程式为__________________。