氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
| A.③④⑤ | B.③④⑥ | C.②③⑤ | D.②③⑤⑥ |
下列关于浓硫酸的说法中,不正确的是
| A.常作为气体的干燥剂 | B.滴在蔗糖上,蔗糖会变黑 |
| C.常温下不能与铁发生反应 | D.工业上主要采用接触法制备 |
分析下图的能量变化示意图,下列选项正确的是
| A.2C====2A+B;ΔH>0 |
| B.2A+B====2C;ΔH>0 |
| C.2C(g)="===" 2A(g)+B(g);ΔH<0 |
| D.2A(g)+B(g)====2C(g);ΔH<0 |
下列物质的水溶液中,呈碱性的是
| A.Na2CO3 | B.Na2SO4 | C.NH4Cl | D.KAl (SO4) 2 |
下列反应中,不属于取代反应范畴的有
A.CH4+Cl2 CH3Cl+HCl CH3Cl+HCl |
B. +HNO3 +HNO3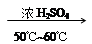 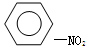 +H2O +H2O |
C.2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CHO+2H2O |
D.CH3COOCH2CH3+H2O  CH3COOH+CH3CH2OH CH3COOH+CH3CH2OH |
下列说法中不正确的是
| A.乙烯能与溴的四氯化碳溶液反应使溶液逐渐褪色 |
| B.乙醛能与新制氢氧化铜反应产生砖红色沉淀 |
| C.糖类物质都能发生水解反应 |
| D.在一定条件下,氨基酸之间能发生反应 |