某学生设计了如图的方法对A盐进行鉴定:
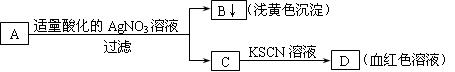
|
由此分析,下列结论中,正确的是
| A.A中一定有Fe3+ | B.C中一定有Fe3+ |
| C.B为AgI沉淀 | D.A一定为FeBr2溶液 |
下列说法中不正确的有
①火灾现场有大量活泼金属存放时,用水灭火
②铝盐、铁盐有净水作用,向浑浊的水中加入少量明矾或硫酸铁溶液,搅拌,过一段时间,
水的底部会出现很多絮状不溶物,水变澄清透明
③地球上存在的天然二氧化硅形态有结晶形和无定形两大类,统称硅石
④常温下,将氯气通入NaOH溶液中可以得到以次氯酸钠(NaClO)为有效成分的漂粉精
⑤氯化物在化学工业领域有重要应用,例如SiCl4、GeCl4、TiCl4分别是制取高纯硅、锗和钛
的重要中间物质
| A.0项 | B.1项 | C.2项 | D.3项 |
有碳原子数相同的烯烃、炔烃混合气aL,完全燃烧后生成bL CO2和cL水蒸气(温度、压强与原混合气相同),若a∶b∶c=3∶6∶4,则下列叙述中正确的是
| A.原混合气为体积比是1∶1的丙烯和丙炔 |
| B.原混合气为任意体积比的乙烯和乙炔 |
| C.原混合气为体积比为2∶1的丁烯和丁炔 |
| D.原混合气为体积比为1∶2的乙烯和乙炔 |
已知: ,如果要合成
,如果要合成 ,所用的原始原料可以是
,所用的原始原料可以是
| A.3-甲基-l,3-丁二烯和3-丁炔 |
| B.1,3-戊二烯和2-丁炔 |
| C.2,3-二甲基-1,3-戊二烯和乙炔 |
| D.2,3-二甲基-l,3-丁二烯和丙炔 |
三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下:
下列化合物中,经过烯烃复分解反应可以生成 的是
的是
在 分子中,处于同一平面上的C原子数最多可能是
分子中,处于同一平面上的C原子数最多可能是
| A.12个 | B.14个 | C.15个 | D.20个 |