设 表示阿伏加德罗常数,下列叙述中正确的是
表示阿伏加德罗常数,下列叙述中正确的是
①.31g白磷含有的P—P键数为 ②. 1mol
②. 1mol (碳正离子)中含有电子数为10
(碳正离子)中含有电子数为10 ③. 1mol铜与足量硫蒸气反应,转移电子数为2
③. 1mol铜与足量硫蒸气反应,转移电子数为2 ④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2 个电子 ⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA ⑥.0.84 g
个电子 ⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA ⑥.0.84 g 晶体中阳离子和阴离子总数为0.03
晶体中阳离子和阴离子总数为0.03 ⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑧.标准状况下,3.2g铜与足量的浓硝酸反
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑧.标准状况下,3.2g铜与足量的浓硝酸反 应生成的气体含有的分子数是0.1NA ⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023 ⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
应生成的气体含有的分子数是0.1NA ⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023 ⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧ B ③④⑥⑦⑧ C ④⑦ D④⑥⑨⑩
将mg含氧化铁、氧化铜和氧化亚铁的样品投入物质的量浓度为1mol/L的2L盐酸溶液中恰好完全反应,若向等质量的该样品通入足量的氢气并加热充分反应后所得金属的质量是
| A.(m-16)g | B.(m+16)g | C.(m-32)g | D.16g |
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-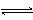 H++A2-。现有下列四种溶液①0.0lmol/L的H2A溶液②0.0lmol/L的NaHA溶液 ③0.02mol/L的HC1溶液与0.04mol/L的NaHA溶液等体积混合④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
H++A2-。现有下列四种溶液①0.0lmol/L的H2A溶液②0.0lmol/L的NaHA溶液 ③0.02mol/L的HC1溶液与0.04mol/L的NaHA溶液等体积混合④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是()
A.溶液②中存在水解平衡:HA-+H2O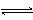 H2A+OH-
H2A+OH-
B.溶液③中有:c(HA-)+c(A2一)=c(Na+)
C.溶液④中有:c(OH一)=c(H+) +c(HA-) +2c(H2A)
D.四种溶液中c(HA-)浓度大小:③>②>①>④
下表所列各组物质中,各物质间能按照下图所示通过一步反应就能完成转化的是
常温时,下列关于电解质溶液的叙述正确的是()
| A.稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B.pH均为5的盐酸和氯化铵溶液中,水的电离程度相同 |
| C.等浓度的碳酸钠与碳酸氢钠溶液相比,碳酸钠溶液的pH大 |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
标准状况下,将5.6L由CO、CH4、C2H4、C2H2组成的混合气体与18LO2混合于某密闭容器中点燃,反应完成后恢复到原状况,得CO2气体7.50L,则下列判断正确的是 ( )
| A.反应完成后,O2没有剩余 |
| B.原混合气体中,C2H4与C2H2的体积共为1.9L |
| C.反应完成后,生成水的质量为9g |
| D.原混合气体中,CO与CH4的体积比一定为1 :1 |