通式为 C6H5—R(R为-H、-C2H5、-OH、-NO2和-COOH)的5 种有机物, 取等质量的5 种物质分别混合于乙醚中, 然后用氢氧化钠溶液来进行萃取, 振荡一段时间, 静置后能够进入水层的物质有 ( )
| A.1 种 | B.2 种 | C.3 种 | D. 4 种 4 种 |
CaC2和ZnC2,Al4C3,Mg2C3,Li2C2等都同属离子型碳化物。请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是()
| A.ZnC2水解生成乙烷(C2H6) | B.Al4C3水解生成丙炔(C3H4) |
| C.Mg2C3水解生成丙炔(C3H4) | D.Li2C2水解生成乙烯(C2H4) |
下列各物质与水的混合物中,能用分液漏斗分离,且当分离出该物质时水留在分液漏斗中的是()
| A.甲苯 | B.乙酸乙酯 | C.溴苯 | D.苯 |
“绿色化学”要求在化工合成过程中,目标产物对反应物的原子利用率达到100%,下列反应类型最符合这一要求的是( )。
| A.取代反应 | B.缩聚反应 | C.加成反应 | D.消去反应 |
从柑橘中可提取萜二烯-1,8,结构如图所示。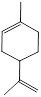
有关萜二烯-1,8的说法正确的是
| A.萜二烯-1,8的分子式为C10H16 |
| B.萜二烯-1,8与足量的H2反应后,产物的分子式为C10H22 |
| C.萜二烯-1,8与1mol的HBr发生加成反应,可以得到2种不同的产物 |
| D.萜二烯-1,8能发生加聚反应 |
心酮胺是治疗冠心病的药物,它具有如下结构简式:下列关于心酮胺的描述错误的是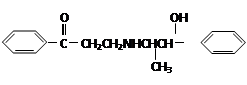
| A.能发生酯化反应 | B.可以在一定条件下和氯气发生加成反应 |
| C.可以发生银镜反应 | D.可与浓溴水反应产生白色沉淀 |