用18.4 mol·L-1的浓硫酸配制100mL1.0mol·L-1稀硫酸。
(1)需量取浓硫酸的体积为 mL(保留一位小数)。
(2)若实验仪器有:
(A)100mL量筒 (B)托盘天平 (C)玻璃棒 (D)50mL容量瓶 (E)10mL量筒 (F)胶头滴管 (G)50mL烧杯 (H)100mL容量瓶
实验时选用的仪器除C、F、G外还应选用(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
(A)定容时俯视刻度线观察液面;
(B)容量瓶使用时未干燥;
(C)定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶的使用中,下列操作不正确的是(填序号)
(A)使用容量瓶前检查它是否漏水
(B)容量瓶用蒸馏水洗净后,不用待配制的溶液洗涤
(C)将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
(D)将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
(E)定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
为提纯下列物质(括号内为少量杂质),填写除杂质试剂及方法:
| 不纯物 |
除杂试剂 |
分离方法 |
| 苯(苯酚) |
||
| 乙醇(水) |
写出下列化学方程式,并注明反应类型
(2)溴乙烷与氢氧化钠的醇溶液在加热条件下反应,反应类型:。
(3)苯酚与溴水的反应,反应类型:。
4分)写出以下键线式所表示的有机物的结构简式: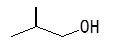
,属于该类有机物的同分异构体还有种。
用质量分数为37.5%的浓盐酸(密度为1.16 g / cm3)配制成1 mol / L的稀盐酸。现实验室仅需要这种盐酸220 mL。试回答下列问题:
(1)配制稀盐酸时,应选用容量为mL的容量瓶;
(2) 经计算需要mL浓盐酸,在量取时宜选用下列量筒中的。
| A.5 mL | B.10 mL | C.25 mL | D.50 mL |
(3) 在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③ 在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)。
(4) 在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是
(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是(填“偏高”、“偏低”、“无影响”)。
用20g烧碱配制成500mL溶液,其物质的量浓度为mol/L;从中取出1mL,其物质的量浓度为mol/L;含溶质g。若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为mol/L,其中含Na+g。