下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |
已知:(1)Zn(s)+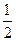 O2(g)===ZnO(s),ΔH1= -348.3 kJ·mol-1,
O2(g)===ZnO(s),ΔH1= -348.3 kJ·mol-1,
(2)2Ag(s)+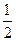 O2(g)===Ag2O(s),ΔH2=-31.0 kJ·mol-1,
O2(g)===Ag2O(s),ΔH2=-31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s)===ZnO(s)+ 2Ag(s)的ΔH等于( )
| A.-379.3 kJ·mol-1 | B.-317.3 kJ·mol-1 |
| C.-332.8 kJ·mol-1 | D.317.3 kJ·mol-1 |
已知肼(N2H4)的燃烧热是534 kJ·mol-1,当它氧化生成1g水时,反应放出的热约为
| A.29.7 kJ | B.14.8 kJ | C.-29.7 kJ/mol | D.-14.8kJ/mol |
已知:CH3COOH(aq)+ NaOH(aq)= CH3COONa(aq)+ H2O(1)△H=-Q1kJ/mol
1/2 H2SO4(浓)+ NaOH(aq)=1/2 Na2SO4(aq) + H2O(1)△H=-Q2kJ/mol
HNO3(aq) + KOH(aq)= KNO3(aq) + H2O(1)△H=-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的大小关系为( )
| A.Q2=Q3 > Q1 | B.Q2 > Q1 > Q3 | C.Q2 > Q3 > Q1 | D.Q3 > Q2 > Q1 |
NA表示阿伏加德罗常数。下列说法中,正确的是
A.标准状况下,H2和O2各11.2L相混合,混合气体所含分子总数为NA |
B.1.8g的NH4+中,所含电子总数为NA |
C.14g乙烯和丙烯的混合物中,所含分子总数为3NA |
D.1 mol·L-1的NaOH溶液中,所含Na+总数为NA |
根据下列短周期元素性质的数据判断,下列说法正确的是
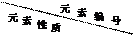 |
① |
② |
③ |
④ |
⑤[ |
⑥ |
⑦ |
⑧ |
| 原子半径/10-10 m |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
| 最高正化合价 |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
| 负化合价 |
-2 |
-3 |
-1 |
-3 |
| A.元素①⑧形成的化合物具有两性 |
| B.元素⑦位于第二周期Ⅴ族 |
| C.元素④⑤形成的化合物是离子化合物 |
| D.元素⑥的最高价氧化物对应水化物碱性最强 |