某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。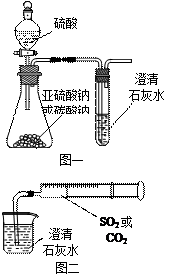
(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
| 饱和石灰水与水的体积比 |
1:0 |
1:1 |
1:2 |
1:3 |
1:5 |
1:7 |
| 能生成CaCO3的最大量(g/100水) |
A |
0.110 |
0.073 |
0.055 |
0.037 |
0.028 |
① 上表中A= g/100g水
Ⅲ 在1.01×105Pa CO2压力下,CaCO3的溶解度
| 热力学温度/K |
282 |
298 |
308 |
| CaCO3溶解度(g/100水) |
0.130 |
0.094 |
0.076 5 |
Ⅳ 在不同压强(CO2)下,CaCO3溶解度(18℃)
| P(CO2)/Pa |
0 |
1.40×104 |
9.95×104 |
| CaCO3溶解度(g/100水) |
0.001 3 |
0.023 3 |
0.108 6 |
认真分析以上数据回答下列问题:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的变化规律是:
③由以上数据可以得出结论:欲观察到“石灰水先变浑浊再澄清的现象”,所需要的实验条件是:
某元素R的二价阴离子核外共有a个电子,核内有b个中子,则R原子的符号应表示为:。
金属钠在700℃ ~800℃时与四氯化钛(TiCl4)反应制取金属钛,该反应的化学方程式为。若过量的相同质量的钠、镁、铝与相同质量分数,相同质量的硫酸溶液反应,产生氢气最多的是。
用11.5g金属钠放入水中,要使100个水分子溶有1个钠离子,则需加水g。
现有X、Y、Z三种非金属元素,A、B、C三种金属元素,已知有如下情况:
(1)X、Y、Z的单质在常温下均为气体
(2)X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
(3)XZ易溶于水,XZ的水溶液可使石蕊试液变红。
(4)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体。
(5)Z的单质溶于X2Y中所得溶液具有漂白性。
(6)A的单质可以在Z的单质中燃烧,生成棕褐色固体,该固体溶于水呈棕黄色。
(7)B与Z形成的化合物BZ2溶于水加入NaOH溶液有蓝色沉淀生成。
(8)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色。
请完成下列问题:
①写出XZ、X2Y和BZ2的化学式:XZ,X2Y,BZ2。
②Z的单质溶于X2Y中所得溶液中起漂白作用的物质是(填化学式)
③A的单质与Z的单质反应的化学方程式:。
④C的单质与Y单质反应生成淡黄色物质的化学方程式:。
⑤Z单质能否与NaOH溶液反应?(填“能”或“不能”)。若能,请写出反应的化学方程式:。(若不能反应,则此空不必填写)。
把少量金属钠投入下列溶液中,写出有关反应的化学方程式:
(1)钠投入稀盐酸中。
(2)钠投入硫酸铜溶液中。