下图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触,而稀硫酸准备的又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
①食盐水 ②KNO3溶液
③适量硫酸铜稀溶液 ④Na2CO3溶液
⑤CCl4 ⑥浓氨水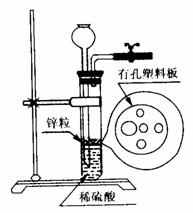
| A.①③⑤ | B.②⑥ |
| C.③⑤ | D.①②④ |
现代家庭装修是居室污染的重要来源,下列物质中不是居室污染物的是
| A.二氧化碳 | B.氨气 | C.三苯(苯、甲苯、二甲苯) | D.甲醛 |
下列物质中,不能发生消去反应的是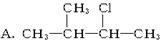 B. CH3CH2Br
B. CH3CH2Br 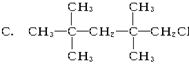 D.CH2ClCH2CH3
D.CH2ClCH2CH3
做为单体,能在一定条件下发生加聚反应生成
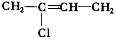
 的是
的是
A.氯乙烯 B.氯乙烯和乙烯
香兰素是重要的香料之一,它可由丁香酚经多步反应合成。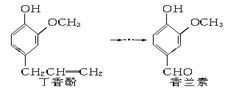
有关上述两种化合物的说法正确的是
| A.常温下,1 mol丁香酚只能与1 mol Br2反应 |
| B.丁香酚不能与FeCl3溶液发生显色反应 |
| C.1 mol香兰素最多能与3 mol氢气发生加成反应 |
D.香兰素分子中至少有 12个原子共平面 12个原子共平面 |
天然维生素P(结构简式如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
| A.可以和溴水反应 |
| B.可用有机溶剂萃取 |
| C.分子中有三个苯环[ |
| D.1 mol维生素P可以和4 mol NaOH反应 |