某一反应体系有反应物和生成物五种物质: O2 H2CrO4 Cr(OH)3 H2O H2O2
已知该反应中H2O2只发生如下过程H2O2→O2
(1)该反应中的还原剂是________________________。
(2)该反应中,发生还原反应的过程是_____________→_____________。
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为_____________。
(1)把暴露在空气中一段时间的金属钠分为两份:一份投入足量水中;另一份放在坩埚中灼烧,再把灼烧后坩埚里的固体物质投入到足量的水中。请分析整个过程中可能发生的化学反应,并按下列要求填写。
①若是非离子反应的请写出化学方程式
②若是离子反应的请写出离子方程式
(2)钙和氢气在一定温度下可化合生成一种灰白色的化合物A,A是一种金属氢化物。取少量A投入水中,剧烈反应并产生一种无色无味易燃气体,同时形成一种碱溶液。请写出化合物A与水反应的化学方程式,并用单线桥标出该反应中电子转移的情况:。
(18分)某化学学习小组用某种粗盐进行提纯实验,步骤如下图所示:
已知粗盐中含有的杂质离子主要为:K+、Mg2+、Ca2+、Fe3+、SO42-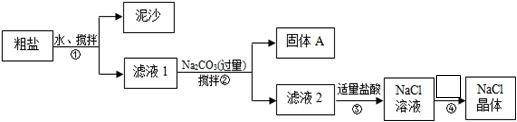
(1)步骤①和②的操作名称是,所需要玻璃仪器为
(2)步骤②中在加入Na2CO3溶液之前还需加入过量NaOH溶液和BaCl2溶液
固体A是:、BaCO3。(用化学式表示)
请写出步骤②中加入NaOH溶液所发生的离子反应(用离子方程式表示):
(3)步骤②中检验SO42-沉淀完全的操作是:
(4)步骤③中加入盐酸的作用是(用离子方程式表示)
(5)步骤④的操作为:、过滤;其中第一步操作所需仪器有:三脚架、玻璃棒、。
(16分)有一固体混合物,可能由K2CO3、Na2SO4、CuSO4、BaCl2、NaCl等其中的一种或几种混合而成。为检验它的成分,做了如下实验:
①将混合物加水溶解,搅拌后得无色澄清溶液。
②往此溶液中滴加足量硝酸钡溶液,有白色沉淀生成。
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀完全不溶解。试判断:
(1)固体混合物中肯定有,肯定没有,可能有。(均填化学式)
(2)对可能有的物质,如要检验其是否存在,将如何操作?______ ________________
(3)写出②③发生的有关反应的离子方程式:②
③____________________________________________ _______________ _____
(4)工业上常用电解氯化钠溶液的方法制Cl2,其化学方程式为: 2NaCl + 2H2O 通电 2NaOH + H2↑ + Cl2↑,用单线桥法表示该反应电子转移情况。
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol.
2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol.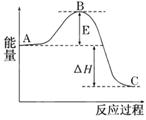
请回答下列问题:
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________.该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是
(2) 图中反应是(填“吸热”或“放热”)反应,该反应(填“需要”或“不需要”)提供能量。
(3)如果反应速率v(SO2)为0.05 mol/(L·min),
则v(O2)=__________mol/(L·min)、v(SO3)=________ mol/(L·min).
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程).
(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)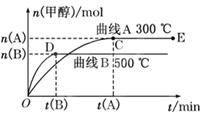
根据题意完成下列问题:
(1)反应达到平衡时,平衡常数表达式K=______,升高温度,K值______(填“增大”“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________.
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的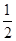 ,下列有关该体系的说法正确的是____.
,下列有关该体系的说法正确的是____.
| A.氢气的浓度减少 | B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 | D.重新平衡时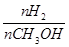 增大 增大 |