高铁酸钾 (K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:2Fe(OH)3 +3ClO-+4OH- =2FeO42- +3Cl- +5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
下列有关说法不正确的是:( )
| A.高铁酸钾中铁显+6价 |
| B.湿法中每生成1mol Na2FeO4转移3mol电子 |
| C.干法中每生成1 mol Na2FeO4转移4mol电子 |
| D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质 |
有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2②KCl ③NaOH ④CuSO4 ⑤Na2SO4如果不用其他任何试剂(包括试纸),用最简便的方法将它们——鉴别开来,则在下列的鉴别顺序中,最合理的是
| A.④③①⑤② | B.④①③⑤② | C.①⑤③④② | D.③④①⑤② |
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温同压下相同体积的O2时,三个反应中转移的电子数之比为
| A.1:1:1 | B.2:2:1 | C.2:3:1 | D.4:3:2 |
标准状况下a L H2和Cl2的混合气体,经光照充分反应后,所得气体恰好使溶液中b mol NaOH完全转变成盐,则a、b的关系不可能是
A.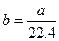 |
B. |
C. |
D. ≥ ≥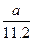 |
24 mL 0.05 mol·L-1的 Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2R2O7的溶液完全反应,则R元素在还原产物中的化合价为
0.02 mol·L-1的K2R2O7的溶液完全反应,则R元素在还原产物中的化合价为
| A.0 | B.+2 | C.+3 | D.+6 |
已知10 ml Na2R溶液含Na+的微粒数为N,则该Na2R溶液的物质的量的浓度为
A.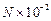 mol/L mol/L |
B.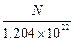 mol/L mol/L |
C.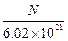 mol/L mol/L |
D.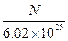 mol/L mol/L |