下面关于电解质电离的叙述正确的是( )
| A.CaCO3在水中溶解度很小,其导电能力很弱,所以 CaCO3是弱电解质 |
| B.CaCO3在水中溶解度很小,但溶解的 CaCO3全部电离,所以 CaCO3是强电解质 |
| C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质 |
| D.水难电离,纯水几乎不导电,水是非电解质 |
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C物质的量变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是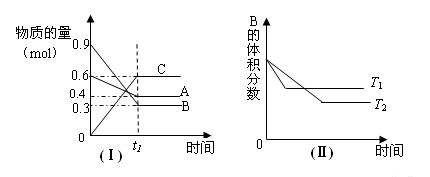
A.在(t1+1)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.在(t1+1)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.不再增减物质,只改变压强或温度时,A的体积分数V(A)%变化范围为25%<V(A)%<40%
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
用惰性电极电解饱和食盐水,当电源供给0.2 mol电子时,停止通电。若此溶液体积为2 L,则所得电解液的pH是
| A.1 | B.8 | C.13 | D.14 |
把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
| A.1:2:3 | B.3:2:1 | C.6:3:1 | D.6:3:2 |
为了配制NH4+与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH
| A.①② | B.③ | C.③④ | D.④ |
控制适合的条件,将反应2Fe3++ 2I-= 2Fe2++ I2设计成如下图所示的原电池。下列判断不正确的是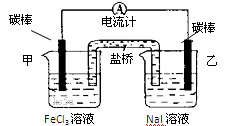
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 |