近年来,我国储氢钠米碳管研究获重大进展,电弧法合成的碳纳米管常伴有大量物质――碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7+ H2SO4(稀) → CO2↑+ K2SO4+ Cr2(SO4)3+
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是_______________,氧化产物是________________。
(3)H2SO4在上述反应中表现出来的性质是_________(填选项编号)。
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生11g气体物质,则转移电子的数目为_________。
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

(1)基态硼原子的电子排布式为。
(2)关于这两种晶体的说法,正确的是(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为,其结构与石墨相似却不导电,原因是。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mol NH4BF4含有mol配位键。
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_______个未成对电子,Fe3+的电子排布式为_________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为____________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为____、。乙酸的沸点明显高于乙醛,其主要原因是___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数 nm,晶胞中铝原子的配位数为。列式表示Al单质的密度g
nm,晶胞中铝原子的配位数为。列式表示Al单质的密度g cm-3。(Al相对原子量27)
cm-3。(Al相对原子量27)
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示图为___________.
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为_________;分子中既含有极性共价键、又含有非极性共价键的化合物是_________;(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是__________;酸根呈三角锥结构的酸是___________。(填化学方式)
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为_________。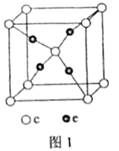
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。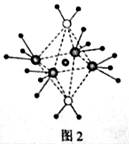
该化合物中,阴离子为________,阳离子中存在的化学键类型有__________
(19分)已知:RCH2COOH

 +RCl
+RCl
 +NaCl
+NaCl
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
(1)A为一元羧酸,8.8 g A与足量NaHCO3溶液反应生成2.24 L CO2(标准状况), A的分子式为。
(2)写出符合A分子式的所有甲酸酯的结构简式:。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B C的反应方程式:。
C的反应方程式:。
(4)C+E F的反应类型为。
F的反应类型为。
(5)写出A和F的结构简式:A.;F.。
(6)D的苯环上有两种氢,它所含官能团的名称为;写出a、b所代表的试剂:a.;b.。
II.按如下路线,由C可合成高聚物H:
C G
G H
H
(7)C G的反应类型为。
G的反应类型为。
(8)写出G H的反应方程式:。
H的反应方程式:。
(13分)已知X、Y、Z、M、W、R是前四周期中的六种元素。X元素原子形成的离子是一个质子,Y原子的价电子构型为2s22p2,Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的。
(1)24R原子最外层的电子排布图是________________,ZO3-的空间构型是______________
(2)Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是_____________,Y、Z、W三种元素的电负性由大到小的顺序是_____________。
(3)Ne与W n-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是_______________(填化学式)。
(4)ZX4W在物质中,各种粒子间的相互作用力包括___________(填字母编号)。
| A.非极性共价键 |
| B.极性共价键 |
| C.配位键 |
| D.离子键 |
E.氢键