有可逆反应mA(s)+nB(g) pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是
| A.到达平衡后,若使用催化剂,C的质量分数增大 |
| B.平衡后,若升高温度,平衡则向逆反应方向移动 |
| C.平衡后增大A的量,有利于提高A的转化率 |
| D.化学方程式中一定是n>p+q |
化学与人类生活、社会可持续发展密切相关。下列有关叙述中不正确的是
| A.锅炉长时间使用硬水易形成水垢造成危害,除水垢的方法是加入碳酸钠溶液浸泡,再加入稀盐酸 |
| B.石油分馏得到的轻质油较少,可以通过裂化、裂解、催化重整的方式得到更多的轻质油 |
| C.废旧电池含有重金属,易造成水体污染和土壤污染,不能随意丢弃,要分类回收并利用 |
| D.开发核能、太阳能等新能源,利用二氧化碳制造全降解塑料都可直接降低碳排放 |
下列有关说法或推断正确的是
| A.由H+(aq)+OH-(aq)=H20(1) △H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ |
| B.由C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定 |
| C.由N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ |
D.增加反应物浓度可使平衡正向移动,故对反应C(s)+H2O(g)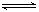 CO(g)+H2(g)ΔH>0,若平衡后再充入一定量水蒸气,则ΔH增大 CO(g)+H2(g)ΔH>0,若平衡后再充入一定量水蒸气,则ΔH增大 |
下列图示与对应的叙述相符的是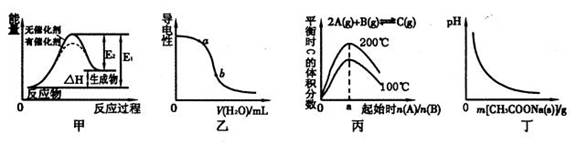
| A.图甲表示催化剂能改变化学反应的焓变 |
| B.图乙表示向氨水中加水时溶液导电性的变化情况,且溶液c(OH—)大小:a<b |
C.由图丙可知反应2A(g)+B(g)  C(g)的△H >O,且 a=2 C(g)的△H >O,且 a=2 |
| D.图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化情况 |
已知反应:①SeO2+4KI+4HNO3 =Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O。
下列叙述正确的是
| A.反应①中Se是氧化产物,I2是还原产物 |
| B.反应②中浓H2SO4是氧化剂,SeO2是还原产物 |
| C.反应①中每有1.0mol I2生成,转移电子数目为4NA |
| D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 |
下述实验不能达到预期实验目的的是
| 选项 |
实验内容 |
实验目的 |
| A |
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 |
证明该溶液中存在SO32- |
| B |
室温下,分别向2支试管中加入相同体积.相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
| C |
向0.1mol/LAgNO3溶液中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成,再向其中滴入0.1mol/L KI溶液,观察沉淀颜色变化。 |
比较AgCl与AgI溶解度的相对大小 |
| D |
向含有少量FeCl3的MgCl2酸性溶液中加入Mg(OH)2,加热并搅拌,过滤。 |
除去MgCl2酸性溶液含有的少量FeCl3 |