配制一定体积、一定物质的量浓度的溶液时,使配得的溶液浓度偏大的是
| A.容量瓶中原有少量蒸馏水 |
| B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C.定容时观察液面俯视 |
| D.定容时倒转容量瓶几次,发现凹液面最低点低于标线,再补几滴水到标线 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )。
| A.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA |
| B.常温常压下,1 mol氦气含有的核外电子数为4NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D.0.5 mol雄黄(As4S4,结构如图)含有NA个S—S键 |

下列物质的转化在给定条件下能实现的是( )。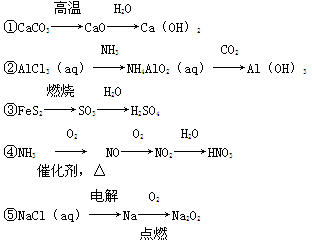
| A.①③ | B.①④ | C.②④ | D.③⑤ |
下列实验操作能够达到实验目的的是( )。
| A.用激光笔鉴别淀粉溶液和蔗糖溶液 |
| B.实验室采用上图所示装置收集SO2 |
| C.除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 |
| D.配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗 |
下列有关物质的性质或应用的说法正确的是( )。
| A.铝合金是一种混合物,它比纯铝的熔点高 |
| B.水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| C.一定条件下,秸秆可以制得葡萄糖和酒精 |
| D.从海水中得到氯化镁,电解氯化镁溶液可获得Mg |
下列各组离子在指定的溶液中能大量共存的是( )。
| A.pH=14的溶液中:Na+、Al3+、Cl-、NO3- |
| B.滴入KSCN溶液显血红色的溶液中:K+、Fe2+、SO42-、Cl- |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、K+、HCO3-、NO3- |
| D.c(I-)=0.1 mol·L-1的溶液中:Na+、Fe3+、ClO-、SO42- |