某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,并取出100mL该盐酸溶液与2mol/L的Ba(OH)2溶液进行中和反应。
(1)根据公式 ,可知该HCl气体的物质的量为________。
(2)根据公式 ,可知所配成的盐酸溶液的物质的量浓度为 。
(3)100mL盐酸溶液中含HCl的物质的量为 ,
(4)根据化学反应方程式 ,可知反应过程中n[Ba(OH)2]: n(HCl) = ,所以n[Ba(OH)2]为 mol,因此,反应所消耗的的体积Ba(OH)2为 。
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:A(g) + 3B(g)  2C(g)
2C(g)
(1)向M、N中,各通入1mol A和3mol B。初始M、N容积相同,并保持温度不变。则到达平衡时A的转化率α(A)Mα(A)N A的体积分数x(A)Mx(A)N
(2))向M、N中,各通入x molA和y molB,初始M、N容积相同,并保持温度不变。若要平衡时保持A气体在M、N两容器中的体积分数相等,则起始通入容器中的A的物质的量xmol与B的物质的量ymol之间必须满足的关系式为
(3)若在某件下,反应A(g) + 3B(g)  2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为;保持温度和压强不变,向此容器内通入0.36mol A,平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由
2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为;保持温度和压强不变,向此容器内通入0.36mol A,平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由
。
(12分)
本题共有3个小题,回答有关问题:
(1)检验牙膏中含有甘油的试剂是,实验现象;有关反应的化学方程式。
(2)在两烧杯中盛有甲、乙两种不同的稀溶液,用铁丝做电化腐蚀实验。实验进行一段时间后,A试管中液面高于烧杯中液面,B试管中液面低于烧杯中液面,试比较pH值大小:
甲乙(填“<”、“>”或“=”),并写出A中铁丝发生腐蚀时的电极反应式:负极,正极。
(3)已知某溶液中只存在 、H+、
、H+、 、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
I:
II:
III: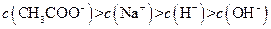
IV:
①若溶液中只溶解了一种溶质,则该溶质是,上述四种离子浓度的大小顺序
为(填编号)。
②若上述关系中III是正确的,则溶液中溶质为
③若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为
 (填“<”、“>”或“=”),混合前
(填“<”、“>”或“=”),混合前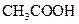 溶液中的
溶液中的
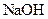 溶液中的
溶液中的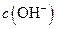 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
已知可逆反应CO(g)+H2O(g) CO2(g) + H2(g),
CO2(g) + H2(g),
(1)写出该反应的化学平衡常数表达式:K= 。
(2)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为;K值为。
(3)830K时,若只将起始时C(H2O)改为6mol/L,则水蒸气的转化率为。
(4)若830K时,起始浓度 C(CO) =" a" mol/L, C(H2O) ="" b mol/L,H2的平衡浓度为
C(H2) =" c" mol/L,则:
①a、b、c之间的关系式是;②当a=b时,a=c。
(6分)试回答下列问题(温度均为25℃时):
(1)将0. 2mol / L HB溶液与0.1 mol / LMOH溶液等体积混合,测得混合溶液的pH=4,则混合溶液中由水电离出的c(H+)____0. 2 mol / L HB溶液中由水电离出的c(H+)。(填“>”、“<”或“="”" )
(2)pH=13的Ba(OH)2溶液a L与pH=3的HCl溶液b L混合。若所得混合溶液呈中性,
则a∶b=;
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O则阴极反应式为________________________________。
甲、乙、丙、丁是1~18号元素,乙元素原子有三个电子层,第一层与最外层电子数相等;甲元素原子的核外电子数比乙元素原子核外电子数少1;丙元素原子的最外层电子数是次外层电子数的2倍;丁元素原子核电荷数比丙元素原子核电荷数多2。请回答:
(1)甲的单质与水反应的化学方程式为;
(2)乙元素的原子结构示意图为;
(3)丙元素的最高价氧化物可以和甲与丁两种元素形成的某种化合物反应生成丁单质,每生成1mol丁单质,转移电子的物质的量为mol。
(4)写出一个能够证明乙单质的还原性比丙单质的还原性强的化学方程式
。