22.向含有0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体,当通入气体为6.72L(标准状况下)时立即停止,则这一过程中,溶液中离子的物质的量(mol)与通入的CO2气体的体积(L)关系正确的图象是(气体的溶解忽略不计)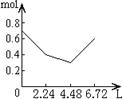
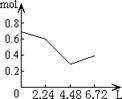
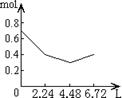
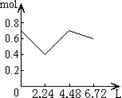
A B C D
在密闭容器中发生反应 aA(g)  cC(g)+dD(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍。下列叙述正确的是
cC(g)+dD(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍。下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a<c+d |
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
B.反应H2(g) + I2 (g)  2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 |
| C.反应CO(g)+NO2(g) = CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深 |
| D.增大压强,有利于SO2与O2反应生成SO3 |
对于反应A(g)+2B(g) 2C(g) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
2C(g) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
密闭的烧瓶里盛放气体A,在25℃时建立平衡:2A(g) B(g) ΔH<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是
B(g) ΔH<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是
| A.平均相对分子质量 | B.密度 | C.容器内的压强 | D.物质的量 |
在体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
| A.N2为0.2 mol·L-1,H2为0.6 mol·L-1 |
| B.N2为0.15 mol·L-1 |
| C.N2、H2均为0.18 mol·L-1 |
| D.NH3为0.4 mol·L-1 |