(12分,每空2分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定过氧化氢的含量。
请填写下列空白:
(1)移取10.00 mL密度为ρg/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。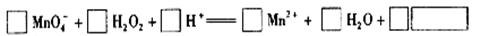
(3) 滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_________。
(4) 重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
如图均为元素周期表短周期的一部分,其中b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,下列有关a、b、c、d、e五种元素的叙述中,正确的是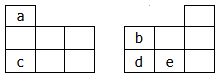
| A.原子半径:b > c |
| B.由a、b、e三种元素形成的化合物可能是离子化合物 |
| C.c与e以原子个数比2:1形成的化合物能促进水的电离 |
| D.氢化物的稳定性:b < d |
下列实验操作、现象和结论均正确的是
| 实验操作 |
现象 |
解释 |
|
| A |
常温下,用pH计测定NaHCO3溶液的pH |
pH=8.5 |
HCO3-的水解程度大于电离程度 |
| B |
向一定量的浓硫酸中加入过量的锌粒,微热至反应结束 |
产生气泡 |
该气体成分仅为SO2 |
| C |
往盛有少量水的两支试管中分别加入Na和Na2O2 |
固体溶解,产生气泡 |
两个反应中水都作氧化剂 |
| D |
往滴有KSCN的FeCl2溶液中通入少量Cl2 |
溶液由浅绿色变血红色 |
氧化性:Cl2> Fe3+ |
常温下,下列说法错误的是
| A.pH=6的NaHSO4溶液:c(Na+)+ c(H+)= 2c(SO42-)+ c(OH-) |
| B.0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 |
| C.pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①> ② |
| D.0.1 mol/L Na2SO3溶液:c(Na+)= 2c(SO32-)+ c(HSO3-)+ c(H2SO3) |
按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)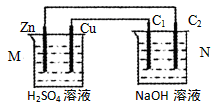
| A.工作一段时间后装置M、N中溶液pH均增大 |
| B.M装置中H+移向Zn电极 |
| C.C2上发生氧化反应 |
| D.Cu电极与C1电极发生的电极反应相同 |
设nA表示阿伏加德罗常数的数值,下列说法正确的是
| A.1L 1 mol·L-1盐酸中含有nA个HCl分子 |
| B.32g O2与O3的混合物含有2nA个氧原子 |
| C.1L 1 mol·L-1 CuCl2溶液中含有nA个Cu2+ |
| D.1mol Na与足量Cl2反应,转移2nA个电子 |