I2在KI溶液中存在下列平衡:I2(aq)+I-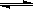 I3-(aq)。测得不同温度下该反应的平衡常数K如下表:
I3-(aq)。测得不同温度下该反应的平衡常数K如下表:
| t/℃ |
5 |
15 |
25 |
35 |
50 |
| K |
1100 |
841 |
680 |
533 |
409 |
下列说法正确的是
A.反应I2(aq)+I-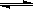 I3-(aq)的ΔH>0 I3-(aq)的ΔH>0 |
| B.其他条件不变,升高温度,溶液中c(I3-)减小 |
| C.该反应的平衡常数表达式是K=c(I2)·c(I-)/c(I3-) |
| D.25℃时,向溶液中加入少量KI固体,平衡常数K小于680 |