设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A.常温常压下,11.2 L氧气所含的原子数为NA |
| B.1.8 g的NH4+离子中含有的电子数为11 NA |
| C.常温常压下,48 g O3含有的氧原子数为3 NA |
| D.2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
下列叙述不能体现“化学让生活更美好”这一主旨的是
| A.风力发电,让能源更清洁 | B.合成塑料,让材料更丰富 |
| C.合成药物,让人类更健康 | D.环保涂料,让环境更宜居 |
在两个恒容容器中有平衡体系:A(g) 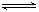 2B(g)和2C(g)
2B(g)和2C(g) 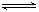 D(g),X1和X2分别是A和C的转化率。在温度不变时,均增加相同的A和C的物质的量,下列判断正确的是
D(g),X1和X2分别是A和C的转化率。在温度不变时,均增加相同的A和C的物质的量,下列判断正确的是
| A.X1降低,X2增大 | B.X1、X2均降低 |
| C.X1增大,X2降低 | D.X1、X2均增大 |
某温度下,4mol NO与定量O2在恒压条件下进行反应,刚开始时气体混合物为2体积,当反应达平衡时,气体混合物占1.5体积,O2为0.5mol。在该温度和压强下,NO转化率为
| A. 50% | B. 60% | C. 75% | D. 80% |
下列各图是温度(或压强)对应2A(s)+2B(g)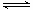 2C(g)+D(g)△H>0的正、逆反应速率的影响,其中正确的是
2C(g)+D(g)△H>0的正、逆反应速率的影响,其中正确的是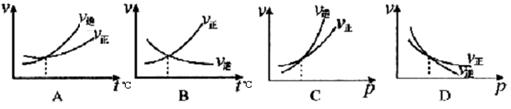
在体积和温度不变的密闭容器中充入1mol H2O蒸气和足量铁粉,建立平衡
3Fe(s)+4H2O(g)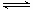 Fe3O4(s)+4H2(g)之后,测得H2O蒸气的分解率为x%,浓度为c1mol/L。若再充人1mol H2O蒸气,建立新的平衡后.又测得H2O蒸气的分解率为y%,浓度为C2 mol/L。则下列关系正确的是
Fe3O4(s)+4H2(g)之后,测得H2O蒸气的分解率为x%,浓度为c1mol/L。若再充人1mol H2O蒸气,建立新的平衡后.又测得H2O蒸气的分解率为y%,浓度为C2 mol/L。则下列关系正确的是
| A.x>y,c1>c2 | B.x<y,c1<c2 | C.x=y,c1 =c2 | D.x=y,c1<c2 |