下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g) ==2H2O(l);△H=-571.6kJ·mol-1,则H2的燃烧热为285.8kJ·mol-1 |
| B.已知4P(红磷,s)="=" P4(白磷,s);△H>0,则白磷比红磷稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) ="=" CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1 |
| D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)="2CO(g)" △H2,则△H1>△H2 |
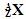 与
与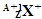 的两种微粒,下列叙述正确的是( )
的两种微粒,下列叙述正确的是( )
| A.一定都是由质子、中子、电子组成的 |
| B.化学性质几乎完全相同 |
| C.核电荷数和核外电子数一定相等 |
| D.质子数一定相同,质量数和中子数一定不相同 |
生命起源的研究是世界性科技领域的一大课题,科学家认为生命起源的第一层次是产生与硝基化合物可能是同分异构体的物质,这类物质是()。
| A.糖 | B.氨基酸 | C.醇 | D.羧酸 |
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是()
①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L醋酸;④用等量锌粉代替锌粒;
⑤增大压强
| A.①③④⑤ | B.①②④ | C.①②③④ | D.①②④⑤ |
下列用水就能鉴别的一组物质是()
| A.苯、己烷、四氯化碳 | B.硝基苯、乙醇、四氯化碳 |
| C.苯、乙醇、四氯化碳 | D.硝基苯、乙醇、乙酸 |
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是()
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.X2Y可能是离子化合物,也可能是共价化合物 |
| D.两元素形成的化合物中,原子个数比不可能为1:1 |