现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥NaOH ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 |
|
氧化物 |
|
|
电解质 |
| 属于该类的物质 |
② |
|
⑧ ⑨ |
⑦ |
|
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-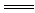 H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。
(3)⑩在水中的电离方程式为  ,
,
1 g ⑩溶于水配成250mL溶液,SO42-的物质的量浓度为 。
(4)少量的④通入⑥的溶液中反应的离子方程为 。
(12分)我国有广阔的海岸线,海水综合利用大有可为。海水中溴含量为65 mg·L-1,从海水中提取溴的工业流程如下: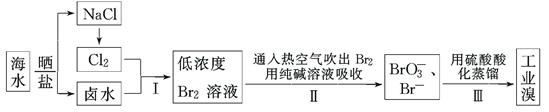
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:
________________________________________________________________________。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。
写出溴与二氧化硫水溶液反应的离子方程式:________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为m/2-n。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲 + H2O → 丙 + 丁。若甲是由N和Cl元素组成的化合物,其分子结构模型如下图所示, 丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的化学式为。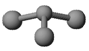
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式)。
(5)写出B与D在高温下完全反应后生成物的电子式___ __,结构式___
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:
n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
苹果酸结构如下,常用做汽水、糖果的添加剂。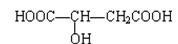
试写出苹果酸分别与下列物质反应的化学方程式:
(1)与Na。
(2)与Na2CO3 __________________________。
(3)与CH3CH2OH按物质的量比1∶2反应(浓H2SO4,△)___________。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质能跟足量的盐酸反应,在标准状况下可置换出22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。试回答:
(1)写出A和C组成的化合物的电子式________________________________;
(2)B的离子结构示意图是,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成一种盐,该盐的化学式是;
(3)写出C元素的单质和甲烷发生一元取代反应的化学方程式____________________;
(4)写出A最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式:
。