下列仪器使用前必须检查是否漏水的是
| A.分液漏斗 | B.漏斗 | C.蒸发皿 | D.长颈漏斗 |
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是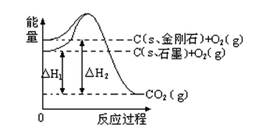
| A.C(s、石墨)="=" C(s、金刚石) △H=" +1.9" kJ•mol-1 |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
海带中富含碘元素,有人设计如下步骤来提取碘:①通足量氯气;②将海带烧成灰,向灰中加水搅拌:③加入CCl4振荡;④过滤;⑤用分液漏斗分液。合理的操作顺序为
| A.②一①一④一③一⑤ | B.②一④一①一③一⑤ |
| C.①一③一⑤一②一④ | D.③一①一②一⑤一④ |
下列装置、试剂选用或操作正确的是
| A.除去NO中的NO2 | B.稀释浓硫酸 |
| C.实验室制取NH3 | D.制备氢氧化亚铁并观察其颜色 |
下列有关硫酸的说法不正确的是
| A.常温下浓硫酸能使铝发生钝化,故可在常温下用铝制贮藏贮运浓硫酸 |
| B.实验室可利用锌与稀硫酸反应制氢气 |
| C.蔗糖中滴入浓硫酸可观察到蔗糖由白变黑,后体积膨胀并产生大量有刺激性气味的气体,该过程中浓硫酸体现了脱水性和强氧化性 |
| D.在以稀硫酸为电解质溶液的铜、锌原电池中,溶液中的SO42-向原电池的正极移动 |
下列由相关实验现象所推出的结论正确的是
| A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |