要配制物质的量浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是
| A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即可制冷。该化学物质是 ()
| A.氯化钠 | B.固体硝酸铵 | C.固体氢氧化钠 | D.生石灰 |
25℃时,向20.00mLNaOH溶液中逐滴加入0.20mo1·L-l的CH3COOH溶液得到如图曲线。下列说法正确的是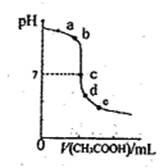
| A.水电离出的氢离子浓度:a>b |
| B.c点时恰好中和 |
| C.在d~e之间存在如下关系:C(Na十)>c(CH3COO-)>c(H十)>c(OH一) |
| D.e点时溶液中溶质是CH3COONa和CH3COOH |
下列说法正确的是
| A.两种难溶物中溶解度小的物质其KSP不一定小 |
| B.同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C.因为Ksp(BaSO4)= 1.08×l0-l0,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀 |
| D.相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>②>① |
下列实验,能达到实验目的的是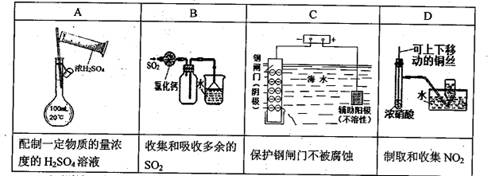
丙烯醇在一定条件下可转化为丙烯醛: 。下列有关说法错误的是
。下列有关说法错误的是
| A.丙烯醇与丙醛(CH3CH2CHO)互为同分异构体 |
| B.丙烯醇含有两种官能团 |
| C.可用新制Cu(OH)2鉴别丙烯醛和丙烯醇 |
| D.此转化过程中丙烯醇被还原 |