将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
| A.2︰3 | B.3︰2 | C.1︰2 | D.1︰1 |
在一个密闭容器中充入一种气态烃和足量的氧气,用电火花点燃,完全燃烧后,容器内气体体积保持不变(均在120℃和相同的压强下测定),这种气态烃可能是()
| A.CH4 | B.C2H6 | C.C2H4 | D.C3H6 |
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如下图所示。有关该物质的说法中正确的是()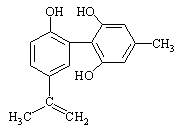
| A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 |
| B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 |
| C.该分子中的所有碳原子不可能共平面 |
| D.1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4mol和7mol |
不能用加氢还原的方法得到的醇是()
| A.CH3OH | B.C2H5OH | C.(CH3)2CHOH | D.(CH3)3COH |
0.1mol两种气态烃组成的混合气体完全燃烧,得到0.16mol CO2和3.6g水,下列说法正确的是()
| A.混合气体中一定有甲烷 | B.混合气体一定是甲烷和乙烯 |
| C.混合气体中一定没有乙烷 | D.混合气体中一定有乙炔 |
在实验室中从苯酚中分离出苯,可选用下列装置中的()