盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知 H2O(g)=H2O(l);△H1=Q1 kJ/mol
C2H5OH(g)=C2H5OH(l);△H2=Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=Q3 kJ/mol
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
| A.Q1+Q2+Q3 | B.0.5(Q1+Q2+Q3) |
| C.1.5Q1-0.5Q2+0.5Q3 | D.0.5Q1-1.5Q2+0.5Q3 |
下列有关说法正确的是()
| A.CaCO3(s)===CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的ΔH<0 |
| B.焓变和熵变是判断反应方向的两个主要因素 |
C.N2(g)+3H2(g) 2NH3 ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 2NH3 ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D.任何情况下,温度都不可能对反应的方向起决定性作用 |
下列事实能说明亚硝酸是弱电解质的是()
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1 mol·L-1 HNO2溶液的pH=2.1
| A.①②③ | B.②③④ | C.①④ | D.①②④ |
下列说法正确的是()
| A.需要加热才能发生的反应一定是吸热反应 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.任何放热反应在常温下一定能发生 |
| D.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
下图为铅蓄电池的示意图。下列说法正确的是()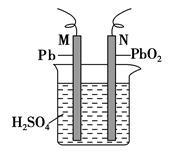
| A.放电时,N为负极,其电极反应式为:PbO2+SO+4H++2e-===PbSO4+2H2O |
| B.放电时,c(H2SO4)不变,两极的质量增加 |
| C.充电时,阳极反应式为:PbSO4+2e-===Pb+SO |
| D.充电时,若N连电源正极,则该极生成PbO2 |
某温度下反应H2(g)+I2(g) 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L-1 H2(g)、0.5 mol·L-1I2(g)及0.3 mol·L-1HI(g),则下列说法中正确的是()
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L-1 H2(g)、0.5 mol·L-1I2(g)及0.3 mol·L-1HI(g),则下列说法中正确的是()
| A.反应正好达到平衡 |
| B.反应向左进行 |
| C.反应向某方向进行一段时间后K<57.0 |
| D.反应向某方向进行一段时间后[H2]<0.2 mol·L-1 |