常温下,某未知酸性溶液中,可能含有大量的Cl-、OH-、CO32-、H+、Ag+、Fe3+ 等离子。你认为其中一定含有的离子是 ,一定不含有的离子是 ,还需进一步检验的离子是 ,为了进一步确认是否含该离子,需要的试剂和现象为 。
在下列变化中:
①干冰气化②硝酸钾熔化③食盐溶于水④HCl溶于水⑤蔗糖溶于水⑥HI分解。用序号填空:
(1)未破坏化学键的是,(2)仅离子键被破坏的是,
(3)仅共价键被破坏的是。
下面列出了几组物质,请将物质的合适组号填写在空格上。①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
(1)是同素异形体的,(2)是同位素的,
(3)是同分异构体的。
今年3月16日,我国发布首部页岩气五年规划――《页岩气发展规划(2011~2015年)》,规划提出,到2015年,页岩气产量将达到65亿立方米/年;到2020年,年产量要达到600亿~1000亿立方米。(1)页岩气是从页岩层中开采出来的天然气,其主要成分是甲烷,另有少量的乙烷、丙烷和丁烷,请写出丁烷所有同分异构体的结构简式、。
(2)页岩气的发展将重塑全球的乙烯市场,使乙烯价格大幅下降,试写出乙烯使溴水褪色的化学方程式,该反应的类型是反应。
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
| Z |
W |
请回答下列问题:
(1)元素Z位于周期表中的第_________周期,_________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质, E为相同物质的量的单质与H2反应过程中的能量变化(
E为相同物质的量的单质与H2反应过程中的能量变化( E越大,表明反应越容易发生)。
E越大,表明反应越容易发生)。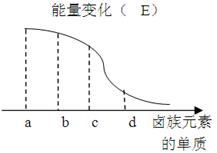
请回答下列问题:
d为_____(写化学式) ,红热的铜丝在b单质中燃烧的现象为.
b与H2反应的条件为______________ .
(2)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次.