化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数。
[方案一]
称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
(2)实验中,需加热至恒重的目的是
。
[方案二]
称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是
。
[方案三]
按如下图所示装置进行实验: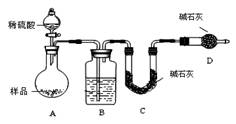
(1)D装置的作用是 。
分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重 8.80g,则样品中NaHCO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:
。
原子序数由小到大排列的四种短周期主族元素X、Y、Z、W,其中Z、W两原子的核外电子数之和为X、Y两原子核外电子 电
电 子数之和的三倍,Y、Z左右相邻,Z、W位于同一主族。
子数之和的三倍,Y、Z左右相邻,Z、W位于同一主族。
(1)Y元素是(填元素名称)。
(2)由X、Y、Z三种元素组成的盐中存在的化学键为。
(3)解释WZ2的水溶液显酸性的原因(用方程式表示)。
(4)某物质由Na、Y、Z三种元素组成,取该物质配成的溶液,滴加AgNO3溶液,有白色沉淀生成,再滴入稀HNO3,白色沉淀溶解,该物质的分子式为。
(5)分别均由X、Y、Z、W四种元素组成的化合物A和B,它们之间能以物质的量1:1进行反应。写出A与B两溶液反应的离子方程式。
(6)Y2X4是一种可燃性的液体,其燃烧产物之一是大气中的主要成分。1 .60g Y2X4在氧气中完全燃烧放出热量31.2 kJ(25℃),请写出Y2X4完全燃烧的热化学反应方程式。
.60g Y2X4在氧气中完全燃烧放出热量31.2 kJ(25℃),请写出Y2X4完全燃烧的热化学反应方程式。
碳酸钙常用作牙膏 的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下。(所用石灰石含有杂质SiO2)
的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下。(所用石灰石含有杂质SiO2)
回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨,则石灰石中碳酸钙的质量分数为%。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为
。
(3)第③步反应一般不采用通入CO2的主要原因是 ,相应的离子方程式为。
,相应的离子方程式为。
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是。
(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下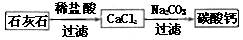
与前一方案相比较,该方案的优点是。
现有下列两组物质:
① H2、CaCO3、HCl、NH3
② 氯化钠溶液、硫酸铜溶液、氢氧化铁胶体、硫酸铁溶液。
请你从组成的元素、物质的性质等多个角度用两种不同的分类标准,从每组中选出一种不同类的物质,并指出其分类标准,写在下面相应的表格内。
| 组别 |
分类标准 |
不属于该类别的物质 |
| 第①组 |
H2 |
|
| 气体 |
||
| 第②组 |
||
铁跟氯气在点燃条件下发生反应:2Fe +3Cl2  2 FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);Cl2作氧化剂,具有性。在该反应中,若消耗了1 mol Fe,则转移_______mol 电子。
2 FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);Cl2作氧化剂,具有性。在该反应中,若消耗了1 mol Fe,则转移_______mol 电子。
⑴写出NaHCO3的电离方程式
(2)写出离子反应方程式Ba2++SO42-=BaSO4↓所对应的一个化学方程式。