下列做法不能体现低碳生活的是 ( )
| A.尽量购买本地的、当季的食物 |
| B.用石油液化气代替天然气 |
| C.瑞士馆用大豆纤维制成的红色幕帷,能发电,可天然降解 |
| D.零排放的燃料电池汽车 |
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是()
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是()
| A.以X的反应速率为0.001 mol·L-1·s-1 |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的ΔH>0 |
下列关于图像及描述说法都正确的是
25℃时,在等体积的① pH=0的H2SO4溶液,②0.05 mol∙L−1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1:10:10 :10 :10 |
B.1:5:5×10 :5×10 :5×10 |
C.1:20:10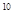 :10 :10 |
D.1:10:10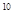 :10 :10 |
已知温度T℃时水的离子积常数为Kw,该温度下,将浓度为a mol∙L−1的一元酸HA与b mol∙L−1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
| A.a =" b" |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)=  mol∙L−1 mol∙L−1 |
| D.混合溶液中,c(H+)+ c(B+) = c(OH-)+ c(A-) |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl−) + c(ClO−) + c(OH−) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3−) > c(CO32−) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl−) = c(NH4+) > c(OH−) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
2c(H+) – 2c(OH−) = c(CH3COO−) – c(CH3COOH)