pH=4的FeCl3溶液和pH=10的Na2CO3溶液中,水的电离度分别为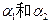 ,则它们的大小关系是 ( )
,则它们的大小关系是 ( )
A.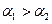 |
B.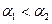 |
C.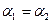 |
D.无法判断 |
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
| A.2︰4︰1 | B.3︰2︰1 | C.2︰3︰1 | D.4︰2︰1 |
下列说法正确的是
| A.工业上利用合成氨实现人工固氮 |
| B.SiO2有导电性,可用于制备光导纤维 |
| C.SO2具有氧化性,可用于漂白纸浆 |
| D.Zn具有还原性和导电性,可用作锌锰干电池的正极材料 |
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是
A.溶质的质量分数为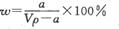 |
B.溶质的物质的量浓度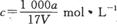 |
C.溶液中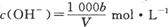 |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于O.5w |
某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是下列中的
| A.Na+ | B.Cl- | C.OH- | D.S2- |
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是
| 序号 |
物质 |
杂质 |
除杂质应选用的试剂或操作方法 |
| ① |
KNO3溶液 |
KOH |
滴入稀HNO3,同时用pH试纸测定至溶液呈中性 |
| ② |
FeSO4溶液 |
CuSO4 |
加入过量铁粉并过滤 |
| ③ |
H2 |
CO2 |
依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ |
NaNO3 |
CaCO3 |
溶解、过滤、蒸发、结晶 |
A.①②③B.②③④ C.①③④D.①②③④