下列溶液中各微粒的浓度关系不正确的是 ( )
| A.0.1mol·L-1HCOOH溶液中:c(HCOO-)=c(H+)·c(OH-) |
| B.1L0.1mol·L-lCuSO4·(NH4)2SO4·6H2O的溶液中: c(SO2-4)>c(NH+4)>c(Cu2+)>c(H+)>c(OH-) |
| C.0.l mol.L-1NaHCO3溶液中: c(Na+)+c(H+)+c(H2CO3)=c(HCO-3)+c(CO2-3)+c(OH-) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中: |
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L
D.最终两试管中Na+、Cl-的物质的量一定相同
现有一块金属钠露置于空气中一段时间,为检验该固体是否部分变质为碳酸钠,先将固体样品溶解于水得到溶液,并采取下列措施,可以实现实验目的的是
| A.测所得溶液的pH |
| B.取溶液滴入酚酞观察是否变红 |
| C.取溶液加入盐酸观察是否有气泡 |
| D.取溶液加入CuSO4观察是否有沉淀 |
如图所示,甲、乙、丙、丁分别代表Na2CO3、NaOH、NaHCO3、CO2四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系。对于图中两种物质间的转化,通过一步反应就能实现的有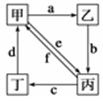
| A.只有a、b、c、d | B.只有b、c、d、e |
| C.只有c、d、e、f | D.a、b、c、d、e、f |
下列物质分类正确的是
| A.SO2、SiO2、CO均为酸性氧化物 |
| B.稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C.烧碱、冰醋酸、四氯化碳均为电解质 |
| D.福尔马林、水玻璃、氨水均为混合物 |
正确掌握化学用语是学好化学的基础。下列化学用语中正确的是
| A.乙烯的结构简式为CH2CH2 | B.羟基的电子式: |
C.Ca2+的结构示意图为 |
D.乙醇的分子式:CH3CH2OH |