设NA为阿伏加德罗常数的值,下列有关叙述中正确的是 ( )
A.标准状况下,密度为dg/L的某纯净气体一个分子的质量为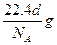 |
| B.标准状况下,11.2LCCl4中含有的C-Cl键的数目为2NA |
| C.17g的氢氧根离子中含有的电子数为9NA |
| D.用100 mL 18.4 mol·L-1的浓硫酸与足量的铜反应,生成SO2的分子数为0.92NA |
对于溶液的酸碱性说法正确的是
| A.c(H+)很小的溶液一定呈碱性 |
| B.pH等于7的溶液一定呈中性 |
| C.c(H+)=c(OH-)的溶液一定呈中性 |
| D.不能使酚酞试液变红的溶液一定呈酸性 |
下列叙述正确的是
| A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 |
| D.过量的铜与浓硝酸反应,生成的气体只有NO2 |
NA为阿伏伽德罗常数的数值,下列叙述错误的是
| A.标准状况下,11.2 L氦气中含有0.5 NA原子 |
| B.标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0. 2 NA |
| C.常温常压下,46g NO2和N2O4混合气体中含有原子总数为3NA |
| D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数NA |
下列说法错误的是
| A.石油主要是由烃组成的混合物 | B.①主要发生物理变化 |
| C.②包括裂化、裂解等过程 | D.③是加成反应,产物名称是二溴乙烷 |
下列叙述正确的是
| A.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
| B.高温或日常用的消毒剂可使禽流感病毒蛋白质变性 |
| C.棉花、羊毛、木材和草类的主要成分都是纤维素 |
| D.误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |