三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物。当加热至一定温度时,它分解产生的HNCO(异氰酸,其结构是H-N=C=O)能和NO2反应:HNCO+NO2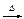 N2+CO2+H2O(未配平)。下列关于该反应的叙述正确的是 ( )
N2+CO2+H2O(未配平)。下列关于该反应的叙述正确的是 ( )
| A.N2是还原产物,CO2是氧化产物 |
| B.每生成1 molCO2需转移12 mol电子 |
| C.反应中氧化剂和还原剂的物质的量之比为3:2 |
| D.N元素既被氧化,也被还原 |
现有C、CO、CO2、 Na2CO3四种物质,采用下列分类标准,无法将其中两种归为一类的是
Na2CO3四种物质,采用下列分类标准,无法将其中两种归为一类的是
A.是否具有还原性 B.是否为氧化物
C.碳元素的化合价是否相同 D.是否为电解质
化学与科学、技术、社会、环境密切相关,下列做法中不正确的是
| A.泄露在美国墨西哥湾海洋中的大量原油能被海洋生物迅速分解,故不会导致生态灾难 |
| B.减少燃煤的使用,改用风能、太阳能等能源,符合“低碳生活”理念 |
| C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D.使用纤维素和淀粉为原料制成的微生物降解塑料,可治理“白色污染” |
30℃时等质量的两 份饱和石灰水,一份冷却到10℃,另一份加入少量氧化钙并保持温度仍是30℃,这两种情况下都不改变的是
份饱和石灰水,一份冷却到10℃,另一份加入少量氧化钙并保持温度仍是30℃,这两种情况下都不改变的是
| A.溶液的质量 | B.氢氧化钙的溶解度 |
| C.溶液中钙离子的数目 | D.溶液中钙离子的物质的量浓度 |
纺织厂除去车间中的粉尘往往通过高压电使之聚集沉降,这利用胶体的性质是
| A.丁达尔现象 | B.电泳 | C.胶体聚沉 | D.布朗运动 |
一定能在下列溶液中大量共存的离子组是:
| A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
| B.C(H+)=1×10-13mol/L的溶液 :K+、Ca2+、SO42-、CO32- |
| C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- |
| D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |