钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨? (保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
①计算此钢样粉术中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到100mL相通浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示: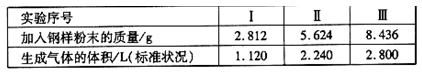
计算硫酸溶液的物质的量浓度。
一定温度下,在密闭容器中,发生反应:2NO2 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化,求:
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化,求:
(1)NO2的起始浓度。
(2)此时NO2的分解率。
反应2A(g) B(g)+xC(g),在一定条件下进行到某一时刻时,在保持恒温恒容的情况下,容器内的压强增大了p%,A的转化率为p%,求x的值。
B(g)+xC(g),在一定条件下进行到某一时刻时,在保持恒温恒容的情况下,容器内的压强增大了p%,A的转化率为p%,求x的值。
25 ℃时,向100 mL含氯化氢 14.6 g的盐酸溶液中,放入5.6 g纯铁粉(不考虑溶液体积的变化),反应开始至2 min末收集到H2 1.12 L(标准状况),在此之后,又经过4 min,铁粉完全溶解。
(1)前2 min内用FeCl2表示的平均反应速率是多少?
(2)在后4 min内用HCl表示的平均反应速率是多少?
(3)前2 min与后4 min相比,反应速率哪个较快?为什么?
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如下表所示:
| 实验序号 |
a |
b |
c |
| 样品质量(g) |
9.6 |
12.8 |
64.0 |
| 气体体积(L) |
5.04 |
6.72 |
V |
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
(1)a组实验结束后,溶液中c(NO3-)= ;
(2)b组实验结束后,溶液的pH= ;
(3)通过计算分析实验c组中产生气体的体积(V) 。
将4.68gNaNO3、NaCl、Na2CO3的混合物溶于水,向其中滴加30mL1.00mol/LAgNO3溶液后,不再有沉淀生成。过滤后,使沉淀与足量稀硝酸作用,产生112mL(标准状况)气体。计算原混合物中NaCl的质量分数。