回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)液氨类似于水的电离,试写出液氨的电离方程式 ;
(3)下列离子方程式书写正确的是 。
A.石灰乳与Na2CO3溶液混合:Ca2++CO32—=====CaCO3↓
B.NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4+ + HSO3- +2OH-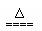 NH3↑+SO32- +2H2O
NH3↑+SO32- +2H2O
C.酸性条件下KIO3溶液与KI溶液反应生成I2: IO32- +5I-+3H2O====3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=====AgOH↓+NH4+
E.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-="====" BaSO4↓+H2O
F.CuSO4溶液吸收H2S气体:Cu2++H2S======CuS↓+2H+
G.AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O ="====" AlO2- +4NH 4+ +2H2O
H.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2++2OH-+NH4+ +HCO3-="== " BaCO3↓+NH3·H2O+H2O
I.LiAlH4溶于适量水后得到无色溶液,则化学方程式可表示为:
LiAlH4+2H2O ="==LiAlO2" +4H2↑
(4) Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 。
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 。
A.3∶2∶1 B.2∶4∶1 C.2∶3∶1 D.4∶2∶1
(1)下表是某食品包装袋上的说明,从表中的配料中分 别选出一种物质填在相应的横线上。
别选出一种物质填在相应的横线上。
| 品名 |
浓缩菠 萝汁 萝汁 |
| 配料 |
水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等。 |
其中属于着色剂的有______________,属于调味剂的有__________________,
属于防腐剂的有_________________,富含维生素的有___________________。
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
| 性质 |
亚硝酸钠 |
氯化钠 |
| 1.酸性条件下的稳定性 |
微热时分解为NO和NO2 |
微热时不分解 |
| 2.熔点 |
271℃ |
801℃ |
| 3.室温时的溶解度 |
约80g |
约35g |
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:_________________________________________
(8分) 某温度(t ℃)时,水的离子积为KW =1×10-13,
(1)则该温度(选填“大于”“小于”或“等于”)_ ________25 ℃。
________25 ℃。
(2)若将此温度下p H =11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),所得混合液为中性,求a∶b等于多少?
H =11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),所得混合液为中性,求a∶b等于多少?
一定温度下,将3molA气体和1molB气体通入一密闭容器中,发生如下反:3A(g)+B(g) xC(g)
xC(g)
请填写下列空白:
(1)若容器体积固定为 2L,反应2min时测得剩余0.6mol B,C的浓度为0.4mol/L。
①2min内,A的平均反应速率为 ;x= ;
②若反应经4min达到平衡,平衡时C的浓度  0.8mol/L(填“大于”、“等于”或“小于”)
0.8mol/L(填“大于”、“等于”或“小于”)
③平衡混合物中,C的体积分数为22%,则B的转化率是 ;
④改变起始物加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的质量的量n(A)、n(B)、n(C)之间应该满足的关系式为 。(请用2个等 式表示)
式表示)
(2)若维持容器压强不变
①达到平衡时C的体积分数 22%,(填“大小”、“等于”或“小于”)
②改变起始物质加入质量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入 molA气体和 molB气体。
25℃时,体积为Va、pH=α的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合后恰好完全反应。若Va>Vb,且α=0.4b,请填写下列空白:
(1)a可否等于2?(填“可”或“否”)__________。
(2)a可否等于4?(填“可”或“否”)__________。
(3)a的取值范围是_____________________。
在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该NaOH溶液中和,需VbLNaOH溶液。填空:
(1)若a + b = 14,则Va∶Vb= _____________(填数字)。
(2)若a + b = 13,则Va∶Vb= _____________(填数字)。
(3)若a + b >15,则Va∶Vb= _____(填表达式)。