某校课外兴趣小组用如图装置进行电解CuC12溶液的实验。实验时 ,在通电一段时间后,观察到阳极上方的淀粉KI试纸不变色,同时,铁棒逐渐溶解;阴极碳棒上有红、白两种颜色的固体析出。同学们对阴、阳两极的产物进行如下探究:
,在通电一段时间后,观察到阳极上方的淀粉KI试纸不变色,同时,铁棒逐渐溶解;阴极碳棒上有红、白两种颜色的固体析出。同学们对阴、阳两极的产物进行如下探究: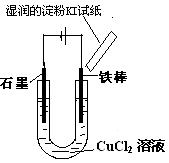
(1)阳极产物探究。
根据实验现象,同学们对阳极发生的电极反应提出了如下假设:
假设1 ;
假设2 。
请你设计实验方案证明你的假设(包括:操作→现象→结论): 。
(2)阴极产物探究:
| 查阅资料 |
铜和铜的化合物中Cu、Cu2O为红色,CuCl、CuBr、CuI为白色,它们在水中均不溶,且稳定存在。 |
| 探究实验 |
取出阴极碳棒,并将其干燥,然后用如图所示装置(气密性良好,药品性能良好)进行实验并记录现象: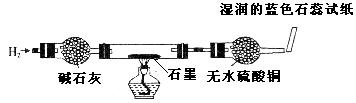 现象:碳棒上红色物质依然存在;白色物质变为红色;无水硫酸铜仍为白色;蓝色  石蕊试纸变为红色 石蕊试纸变为红色 |
结论与解释:
①白色物质为 。
②某学生收集碳棒上的白色物质并装入试管中,滴人稀HNO3,写出白色物质与稀HNO3反应的离子方程式: 。
(12分)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g)ΔH<0
2SO3(g)ΔH<0
(1)写出该反应的化学平衡常数表达式:K=。
(2)降低温度,该反应K值,二氧化硫转化率,化学反应速率(以上均填“增大”、“减小”或“不变”)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如下图所示,反应处于平衡状态的时间段是。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是(用文字表达),10min~15min的曲线变化的原因可能是(填写编号)。
a.加了催化剂 b.扩大容器体积 c.降低温度 d.增加SO3的物质的量
(12分)化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列ΔH表示物质燃烧热的是;表示物质中和热的是。
(填“ΔH1”、“ΔH2”和“ΔH3”等)
A.2H2(g)+O2(g) = 2H2O(l) ΔH1
B.C(s)+1/2O2(g) = CO(g) ΔH2
C.CH4(g)+2O2(g) = CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)= CO2(g) ΔH4
E.C6H12O6(s)+6O2(g) = 6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l)ΔH7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是。
A.C2H6(g)+7/2O2(g) = 2CO2(g)+3H2O(l)ΔH= +2akJ/mol
B.C2H6(g)+7/2O2(g) = 2CO2(g)+3H2O(g)ΔH= -2akJ/mol
C.2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l)ΔH= -4akJ/mol
D.2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(g)ΔH= -4akJ/mol
(3)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),下表是部分化学键的键能数据: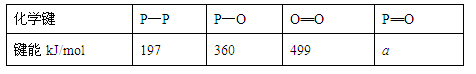
已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如下图所示,则上表中a=。
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为。
图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答: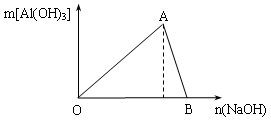
Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比_______;
Ⅱ.(B处溶液中存在的浓度最大的离子是_____________(填离子符号);
Ⅲ.(铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++AlO2-+H2O=Al(OH)3↓+NH3↑。
试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式:;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少。请排出以上各种现象由先到后出现的正确顺序(用序号回答);
(3)向含有0.01mol NH4Al(SO4)2溶液中逐滴加入5mol·L-1NaOH溶液,请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品a g。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有的金属阳离子为________;滤渣中含有的物质为____________;
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中与铝的化合物有关的离子方程式_____________________________。
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至重量不再减少为止,冷却后称量,质量为b g。写出足量CO2通入滤液中所涉及的化学方程式________________。
(5)计算:该样品中铝的质量分数的表达式为___________________________。
有原子序数依次增大的A,B,C,D,E五种短周期元素,它们可两两组成;甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
| 甲 |
乙 |
丙 |
丁 |
|
| 化合物中各元素原子个数比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
其中A,B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多两个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30
(1)试写出各元素的元素符号:A,B,C,D,E。
(2)E元素在周期表中位置,它的最简单离子的结构示意图为:。
(3)化合物丁的空间构型为,其分子电子式为。
(4)E溶液显酸性的离子方程式为:。